





Les philosophes anciens considéraient l'eau comme un
élément de base caractérisant toutes les
substances liquides. Les scientifiques n'abandonnèrent pas
cette idée avant la seconde moitié du
XVIIIe siècle. En 1781, Henry Cavendish réalisa la
synthèse de l'eau en faisant exploser un mélange
d'hydrogène et d'air. Cependant, les résultats de ses
expériences ne furent pas clairement interprétés
avant 1783, lorsque Antoine
(Laurent) de Lavoisier suggéra que
l'eau n'était pas un élément, mais un
composé d'hydrogène ET
d'oxygène.
NOTES - Rappel de la formation des éléments dans le
système solaire (et dans
l'univers).

Ainsi, selon les conditions de production, les éléments peuvent ainsi provenir :
Rappel de quelques Termes ou expressions utilisés en chimie : lien interne
Dans une étude scientifique présentée en 1804, Joseph Louis Gay-Lussac et Alexander von Humboldt démontrèrent conjointement que l'eau (masse molaire 18,0153), était constituée de
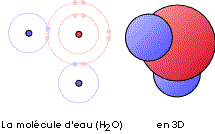
La représentation
proposée ci-dessous, résultat d'un calcul rigoureux
effectué par des scientifiques, montre les régions au
sein desquelles la probabilité de trouver une paire
d'électrons, et une seule, est la plus grande.
La molécule d’eau possède en effet au total dix
électrons dont huit proviennent de l’atome
d’oxygène, les deux autres provenant des deux atomes
d’hydrogène.

Les lobes bleus figurent les domaines où se situent
préférentiellement les paires d'électrons qui
assurent les liaisons oxygène - hydrogène au sein de la
molécule (une paire pour chaque
liaison).
La petite sphère rose matérialise le domaine des deux
électrons de l’atome d’oxygène qui ne
participent pas aux liaisons chimiques, et que l’on appelle des
électrons "de cœur".
Enfin, le domaine rouge-orangé correspond aux 4 derniers
électrons de l’atome d’oxygène groupés
par paires. Ces électrons dits "libres", très
importants, sont ceux qui permettent la formation des fameuses
liaisons hydrogène.
L'eau contient en fait de très faibles quantités :
[voir les pages
internes sur les eaux lourdes
et
superlourdes].
Mais également trois isotopes de l'oxygène
(16O, 17O, 18O), ce qui fait que
l'eau est constituée de molécules de masses très
variées :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Il faut noter que l'hydrogène
(lien
interne sur le gaz H2) est
l'élément le plus abondant de l'univers connu
(le 10ème dans la croûte
terrestre), et l'oxygène
(lien
interne sur le gaz O2)
est le plus abondant sur terre : 46 % de
l'écorce terrestre, soit environ 1,3.1024 kg dans
la croûte terrestre et 1,5.1021 kg libre.
Nota : le rapport D/H de l'eau des océans de la Terre
est de 1,55 10-4 . La valeur du rapport D/H terrestre
étant comprise dans la gamme des rapports D/H des
astéroïdes situés entre Mars et Jupiter,
l’eau des océans sur Terre pourrait ainsi provenir
préférentiellement des astéroïdes et de
certaines comètes.
Ces résultats importants a été publiés en
2014 dans la revue Science Express.

Valeurs des rapports deutérium/hydrogène (D/H) dans
différents objets du Système solaire, regroupés
par couleur avec les planètes et satellites
(bleu), les
chondrites de la ceinture d’astéroïdes
(gris), les
comètes originaires du nuage de Oort
(violet) et les
comètes joviennes
(rose/orangé).
© B. Marty, Esa, Altwegg et al.
suite :
La disposition spatiale des atomes (O en
rouge) > 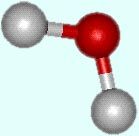
peut présenter différents types structuraux.
Chaque liaison O–H mesure 0,9584 Å
(1 Å = 10-10 m) et l'angle
formé par les atomes d'hydrogène est de 104,45º.
Elle constitue en fait un édifice macromoléculaire
lacunaire, ayant des espèces moléculaires de
proportions variables, en fonction de la pression et de la
température, lui donnant la faculté d'intégrer
un grand nombre de substances
étrangères.
Quelques anomalies constatées sur l'eau sont
expliquées par cet édifice particulier.
Si l'on considère des corps dont les molécules sont
constituées de deux atomes d'hydrogène et d'un
élément du même groupe
(16) de la table périodique des
éléments (colonne dont fait partie
l'oxygène); les températures de fusion et
d'ébullition de ces corps forment une série
régulière (à cause des forces
d'attraction de Van der Walls qui augmente en même temps que la
masse moléculaire).
L'eau fait exception à cette règle, comme le
montre le tableau suivant (dans les conditions de
pression atmosphérique "normale") :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Liaisons
polaires : un des atomes attire plus les électrons
que l'autre, il tend donc à être chargé
négativement et l'autre à être chargé
positivement car les électrons vont rester plus longtemps
autour de lui. Un tel élément est dit
électronégatif., et par ailleurs les charges de signes
contraires s’attirent.
L'eau est formée par de telles liaisons dites polaires.
L'oxygène très électronégatif tend donc
à être chargés négativement tandis que les
deux atomes d'hydrogène tendent à être
chargés positivement. Cette polarité est une
propriété extrêmement importante de la
molécule d’eau.
Les molécules à l’intérieur de laquelle les
charges ne sont pas réparties de manière
homogène, possédent donc des liaisons polaires qui
peuvent interagir facilement avec l'eau, et sont donc solubles. La
plupart des molécules biologiques, peuvent le faire et se lier
ainsi entre elles ou avec des molécules d’eau. Dans l'ADN
par exemple deux brins sont liés entre eux par liaisons
hydrogène.
Ces liaisons, dues à la polarité,
s’établissent donc entre les atomes
d’hydrogène de certaines molécules d’eau et
les atomes d’oxygène de molécules d’eau
voisines, ces interactions étant plus fortes que celles des
forces de Van der Waals (> Loi
de VdW, et autre lien
sur ces forces).
On les appelle des " liaisons
hydrogène ".
Les liaisons hydrogènes et
leurs mouvements confèrent à l'eau ces
propriétés physiques étonnantes : si
elles n'existaient pas, l'eau serait gazeuse aux conditions
normales de température et de pression
(CNTP : 0°C, 1 013.25 hPa).
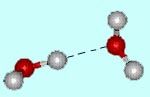
Liaison intermoléculaire, plus faible qu’une liaison
chimique (environ dix fois plus faible, et peuvent
être tordues et même brisées facilement),
la liaison hydrogènene s’établit qu’entre
certaines molécules et implique toujours un atome
d’hydrogène.
Chacun des atomes d'hydrogène d'une molécule d'eau, qui
a tendance à être positif, se lie à l'atome
d'oxygène d'une autre molécule d'eau. Un atome
d'hydrogène, déjà lié de façon
covalente à un atome électronégatif et donc
potentiellement positif, va être attiré vers un autre
atome électronégatif (oxygène ou azote par
exemple).
L’énergie de formation de la liaison hydrogène est
de l'ordre des énergies mises en jeu dans les fluctuation
thermiques à la température ambiante
(27° Celsius). Aussi, de telles liaisons
peuvent-elles se tordre, se rompre ou se restaurer à cette
température.
Toutes les molécules possédant des groupes carbonyles
(C=O) polaires peuvent également se lier par liaisons
hydrogène aux molécules d’eau. Mais la
molécule d’eau est capable d’établir
jusqu’à quatre de ces liaisons. Dans l'eau liquide ou la
glace, où il n’y a que des molécules d’eau,
cela permet d’avoir un nombre de liaisons hydrogène
particulièrement élevé : autant que de liaisons
de valence.
De telles liaisons peuvent exister dans la vapeur d’eau
(lien
interne sur la vapeur), mais l’énergie
d’agitation des molécules y étant
supérieure à l'énergie de ces liaisons, les
molécules ne peuvent s’associer en grand nombre. Elles
peuvent tout au plus s’associer par deux ou par trois pour
former ce que l’on appelle des dimères ou des
trimères. Dans l’eau liquide en revanche, les
molécules d’eau s’associent les unes aux autres sous
la forme de paquets de grande taille qui se font et se défont
en permanence.
Toutefois, même dans de l'eau liquide à des
échelles de temps et de distances très courtes, des
molécules d'eau s'assemblent très transitoirement du
fait des fameuses liaisons hydrogène en donnant des structures
cristallines, appelées « des clusters d'eau ».
Nota : ces liaisons sont très furtives, de l'ordre du
millième de millardième de
seconde...(10-15 s ou 1
picoseconde).
Malgré la présence de ces liaisons, dans l’eau
liquide les molécules d’eau ont encore la
possibilité de changer de positions, car l'agitation thermique
est encore importante et a pour effet principal de permettre à
ces liaisons de se tordre.
Ce type de liaison est ainsi responsable des propriétés
de cohésion, d'adhérence et de tension superficielle de
l'eau.
La liaison hydrogène est aussi capable de transférer
des ions H+ entre les molécules qu'elle lie. Cette
propriété est très importante car elle est
à l’origine de la réactivité des milieux
aqueux. Sans elle, ceux-ci seraient inertes et la vie ne serait pas
possible, car les molécules biologiques doivent en permanence
réagir pour rester actives. On soupçonne que ce sont
les molécules H2O qui autorisent ces transferts
d’ions H+ en établissant certaines liaisons
hydrogène spécifiques (des
molécules telles que des protéines par exemple peuvent
réagir).
Structure moléculaire de la surface
de l’eau (à l’état
liquide) :
L’interface liquide-vapeur à la surface de l’eau est
l’un des environnements hétérogènes
à la fois le plus commun et le plus mystérieux. Les
mesures expérimentales de sa structure moléculaire sont
délicates à réaliser et les modèles
actuels ne s’entendent pas sur les résultats. Pourtant,
comprendre la structure moléculaire de la surface de
l’eau pourrait permettre de mieux comprendre les interactions
qui sous-tendent de nombreux processus biologiques.
Le modèle quantique utilisé par des chercheurs
britanniques - [ Laboratoire national de physique
(NPL),
et avec la collaboration de l’Institut national de mesure, IBM
et de l’université d’Édimbourg ] -
est basé sur une particule chargée fictive dans le
modèle
de Drude, nommée "oscillateur de Drude" ou "modèle
de l'électron amorti" (Paul Drude est un
physicien allemand).
Dans le cas d’une molécule d’eau, cette particule
est attachée à l’atome d’oxygène par
le biais d’un ressort harmonique, mimant la façon dont
les électrons d’une véritable molécule
d’eau oscillent et réagissent à leur
environnement. Des informations auxquelles les modèles
classiques ne donnent généralement pas accès et
qui, surtout, donnent une idée précise des
propriétés moléculaires de l’eau
liquide.
C’est la première fois que le modèle de
l’oscillateur de Drude est appliqué à une
interface liquide-vapeur. Les résultats des chercheurs
britanniques montrent que l’asymétrie
intrinsèque des liaisons hydrogène est responsable de
l’orientation des molécules de surface. Et le
modèle permet également de prédire la
dépendance à la température de la tension
superficielle de l’eau avec une précision de 1 %.
Nouveaux :
>>> page
spéciale, par rapport aux effets
quantiques,
>>> page
spéciale, par rapport aux particules
élémentaires.
C'est peut-être là
leur rôle fondamental, et ce serait grâce à ce
phénomène que la vie est née dans l'eau, et s'y
poursuit !
NB :
Liens web :
> CNRS (liaison
hydrogène),
> un tableau
périodique des élements original,
en vidéos
(University of Nottingham, en
anglais).
Téléchargement d'un logiciel remarquable
et indispensable :
> Classification
Périodique des
Éléments
(zip, 21 Ko) > CPE
de Paul Roux
[paroux@francenet.fr].
Humour
> le
monoxyde de dihydrogène
(Dihydrogen Monoxide - DHMO) - (lien
externe).
Humour lourd'eau :

 Propriétés
physiques de l'
Propriétés
physiques de l'![]()
![]()
![]()
L'eau pure est un
liquide inodore et sans goût.
Elle a une teinte bleuâtre,
qui peut être perçue uniquement lorsqu'elle forme une
couche épaisse.
>Elle
absorbe peu les radiations électromagnétiques (domaine
visible), et sous une grande épaisseur elle paraît donc
bleue, due à une absorption un peu plus élevée
des ondes orangées et rouges du spectre
solaire.
Sous une pression
atmosphérique dite "normale" (760 mm Hg
(760 torr),
ou 101 325 Pa (Pascal)),
le point de congélation de l'eau est de 0°C et son
point d'ébullition est de 100°C
> (voir éventuellement les pages sur la glace
ou la neige),
> (voir éventuellement les pages sur la vapeur
d'eau).
(pour le retour ici,
veuillez utiliser celui de votre navigateur :![]() [par exemple])
[par exemple])
L'eau atteint sa densité maximale à une
température de 4°C et se dilate en se congelant. Comme la
plupart des autres liquides, l'eau peut se trouver dans un
état surfondu, c'est-à-dire qu'elle peut rester
à l'état liquide à une température
inférieure à son point de congélation :
elle peut facilement être refroidie à -25°C sans se
congeler. L'eau surfondue se congèle lorsque sa
température est abaissée ou lorsqu'un cristal de glace
ou une autre particule lui est ajouté.
 Propriétés
"suite".
Propriétés
"suite".
Rappel des changement de phases d'un corps :


NB : °C = Kelvin (K) - 273,15, (Pc,Tc
= pression et température critiques, Pt = point
triple)
La compressibilité de l’eau réserve quelques surprises puisque son coefficient diminue quand la température s'élève (égal à 5,01x10-5 à 0°C), et passe par un minimum à 50°C (4,4x10-5). En fait, si l'eau était rigoureusement incompressible, le niveau de la surface des océans serait plus élevé de 30 m !
Malgré cette particularité, l’eau reste un liquide très faiblement compressible.
Ses propriétés physiques ont fait de l'eau un étalon pour les échelles de température et pour la définition originale de l'unité de masse dans le système métrique, le gramme (g).
En comprimant l’eau liquide, elle devient encore plus fluide contrairement à ce qu’il se passe pour tous les autres corps.
Nota : le coefficient de compressibilité de l'air à pression atmosphérique vaut environ 10-5 Pa-1, et celui de l'eau environ 5·10-10 Pa-1, l'eau est donc vingt mille fois moins compressible que l'air.
La dilatation de l'eau, en se congelant, se produit d'autant plus rapidement avec une variation de température, qu'elle est froide et en dessous de 4 °C. Le phénomène est censé être maximal à -44 °C.
C'est à cette température que des chercheurs (équipe internationale, dont plusieurs sont en poste à l'université de Stockholm) ont mené leurs expériences pour étudier la prise en glace, par la technique de diffraction des rayons X employée en cristallographie.
Il a donc été confirmé que l'eau était bien un mélange complexe oscillant perpétuellement entre deux liquides différents. Mais surtout, les chercheurs en tirent la conclusion que les deux liquides entre lesquels l'eau fluctue peuvent en fait se séparer en deux phases de densités différentes, comme le ferait l'eau et l'huile (comme l'explique comme l'explique dans une vidéo, Anders Nilsson, professeur de physico-chimie à l'université de Stockholm).
En bonus, ces travaux ont montré des différences selon que l'eau était ou non de l'eau lourde D2O. Ces différences doivent provenir d'effets quantiques résultant de l'influence des noyaux d'hydrogène sur les cortèges d'électrons.
- Masse volumique [MV] ou densité en fonction de la température :
> irrégulière, avec un maximum à 3,982°C [277,13 Kelvin] = 999,97 kg/m3 (soit ± 1000 pour env. 4°C)
NOTA : sous 1 atm, soit 101 325 Pa [newton / m²]
(Handbook of Chemistry and Physics - 65th (1985) - F4)
Nota : masse volumique
de la glace
: 917 kg/m3 à 0°C (999,8
pour l'eau pure).
A noter que la
température du maximum de densité s'abaisse avec
l'augmentation de la pression :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
La vitesse
du son
(célérité du son) dépend fortement de la
densité de matière traversée et de la
température (il
n'y a donc pas de son dans le vide),
dans l'eau
elle est d'environ 1 500 m/s, soit 5 580 km/h);
( dans l'air, 340 m/s
[1 224 km/h] à 15°C,
et
dans l'acier, environ 5
600 m/s [20 160 km/h] ).
Dans l'eau
pure : 1 482,343 m/s
(5 336,435
km/h) à 20
°C.
La vitesse du son dans l'eau salée (c) peut
être calculée, à titre d'exemple, par la formule
suivante (source ISTV) :
avec, c vitesse du son en m.s-1, T température
en °C, S salinité et z la profondeur en m,
(on considère que la pression est
hydrostatique).
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------
Nota : formule approchée
qui permet d'obtenir la célérité du son
c
dans
l'air, au niveau
du sol, de -20 à +40 °C, avec une incertitude
inférieure à 0,2 % :
avec T, température en
°C
NB. Cette vitesse c, diminue avec l'altitude :
.jpg)
------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
La
tension
superficielle (ou tension
de surface) est la plus élevée de tous les
liquides (elle explique
la capillarité, les ménisques, et la formation des
gouttes d'eau et des vaguelettes !).
Elle varie en fonction de la température et de la
salinité.
(ci-joint la TS en milli-newtons par mètre
[mN.m-1] pour une eau de salinité 0) :
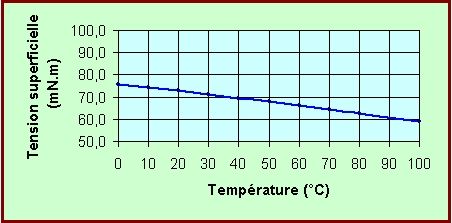
> voir éventuellement, les pages spéciales : tension_sup ( et eau de mer ).
- Ebullition : sous la pression de une (1) atmosphère (1013,25 hPa), l'eau pure bout à 99,975 °C (373,125 K), mais par convention à 100°C (373,15 K), et, à noter que la salinité augmente le point d'ebullition : voir pages eb_salinite.
(> voir également les pages spéciales sur la vapeur)
- Congélation : 0°C (273,15 K), elle décroît avec la pression. et subie une augmentation de volume d'environ 10%, et par ailleurs la salinité abaisse le point de congélation : voir pages cong_salinite ( et voir les pages spéciales sur la glace ).
- Chaleur de formation (DHf (298 K) ) : [H2(g) + O2(g) > H2O(g)] = -285,1 kJ mol-1 ( 15 825,45 - kJ. kg)
NB -inversement (chaleur de décomposition) - H2O(g) > H2(g) + O2(g) : DHf = +242 kJ mol-1 (15 825,45 kJ . kg, 4,396 kWh . kg)
- Chaleur spécifique (Cp) : 1 calorie / g, à 15°C et à la pression atmosphèrique constante de 1013,25 mb (définition de la calorie en unités thermiques) ou 1 kcal/kg/°C ou K, ou 4185,5 Joules/kg/°C ou K (4,1855 kJ . kg . °C ou K).
Elle varie en fonction de la température (courbes de variation à la pression atmosphérique normale) :
------------
Nota : pour la glace d'eau, voir également ces pages spéciales.
Notes de rappel (
échanges
thermiques < lien
interne ) 
- Enthalpie de solidification : 330 kJ.kg-1.K-1 aux conditions TPN (T=273,15 K, P=101 325 Pa),
- Chaleur latente de vaporisation : variable en fonction de la température, soit 40,7 kJ/mol à 100°C
- Tension de vapeur (*) - variable en fonction de la température : 17,5 mm de Hg à 20° C
(sous pression atmosphérique normale (101 325 Pa ou 760 mm de Hg ou 1013,25 millibar)).
* On appelle tension de vapeur d'un liquide pur, la pression sous laquelle ce liquide est en équilibre avec sa vapeur saturante. La tension de vapeur n'est fonction que de la température et de la nature du corps, c'est-à-dire que, pour un liquide pur déterminé, elle ne dépend que de la température. À une température donnée correspond pour le liquide considéré une tension de vapeur fixe.
A noter que la salinité diminue la tension de vapeur d'eau (voir eau de mer).
- Viscosité dynamique (ou absolue) : 1,002.10-3 Poiseuille (Pl) ou 1,002 cPo (centipoise) à 20°C et sous 1 atm (anomalie par rapport aux autres liquides > variabilité en fonction de la température et de la pression) :
.jpg)
A pression atmosphérique - Handbook of Chemistry and Physics - 65th (1985)
Nota : viscosité
cinématique = viscosité dynamique / masse volumique
(MV), unité SI : m²/s, ou en ex unités CGS : Stoke
(St), 10-4 m²/s, ou centistoke (cSt, 10-6
m²/s).
> voir éventuellement, les pages spéciales :
viscosité
dynamique &
viscosité
cinématique.
NB : l'inverse de la
viscosité dynamique est la fluidité
(ou viscosité réciproque), qui est la capacité
d'un fluide à s'écouler sans résistance.
Dans le système CGS, la fluidité s'exprime en
rhé.
La superfluidité
(> page
interne) est un
état de la matière dans lequel celle-ci se comporte
comme un fluide dépourvu de toute
viscosité.
- Point triple : 273,160 K (0,01°C) et 612 Pa (0,000612 MPa).
Ce point correspond aux conditions ou les trois états (solide, liquide et gazeux) peuvent cohabiter.
Expérimentalement, le point triple n'apparaît donc que si la pression est de 612 Pa (0,00612 atm), très basse par rapport à la pression atmosphérique "normale" (1 atm ou 101325 Pa), soit environ 165 fois moins.
Notes : la température en degré Kelvin du point triple de l’eau dépend des abondances relatives des isotopes de l’hydrogène et de l’oxygène présents dans l’échantillon d’eau utilisé, La définition du kelvin se réfère donc à une eau de composition isotopique spécifiée :• à la condition que la composition isotopique de l’eau soit la suivante :
- 0,000 155 76 mole de 2H par mole de 1H
- 0,000 379 9 mole de 17O par mole de 16O
- 0,002 005 2 mole de 18O par mole de 16O
cette composition étant celle du matériau de référence de l’Agence internationale de l’énergie atomique « Vienna Standard Mean Ocean Water (VSMOW) », recommandée par l’Union internationale de chimie pure et appliquée dans « Atomic Weights of the Elements: Review 2000 ».
Source > RECOMMANDATION 2 (CI-2005), Clarification de la définition du kelvin, unité de température thermodynamique. Le Comité international des poids et mesures (CIPM, 94e cession).
Nota : l’hélium est le seul corps connu ne
possédant pas de point triple. Le soufre
présente deux variétés cristallines, donc il
possède 3 points triples.
- Points critiques :
- Température critique [Tc] = 373,946 °C (647,096 ± 0,01 K)
- Pression critique [pc] = 2,212.107 Pa ou 22,064 ± 0,005 MPa (221,2 bars ou 218,3 atmosphères)
- Masse volumique critique [ rc ] = 322 ± 3 kg . m–3
.
Nota : la température
minimum à laquelle l'eau
liquide peut exister est
-21,985°C (251,15
K) à une
pression de 209,9 MPa (2,099.108
Pa ou 2099 bars).
Propriétés
électriques & optiques de l' ![]()
![]()
![]()

Les constituants de l'eau ( H+
et O- ) présentent
une grande
dissymétrie électrique, c'est donc un
liquide
diamagnétique (polaire).
- Résistivité électrique :
(rappel : résistivité (ohms.cm-1) = 1 000 000 / conductivité [en µS.cm-1] )
Très élevée > l'eau pure a une résistivité de l'ordre de 25 méga-Ohm par cm (MW.cm-1) à 20°C (conductivité : 0,04 micro-siemens par centimètre ou mS.cm-1).
L'eau obtenue par déminéralisation a couramment une résistivité de 18 MW.cm-1 (0,0555 m S.cm-1), eau destinée la fabrication de circuits intégrés par exemple.
L'eau potable du réseau de distribution possède une résistivité variable de l'ordre de 0.02 à 0.001 MW.cm-1 (50 à 1000 mS.cm-1).
NB : la conductivité est l'inverse de la résistivité.
Niveau guide de la conductivité à 20°C d’une eau destinée à la consommation humaine : 400 m S.cm-1 (0.0025 MW.cm-1 ou 2500 W.cm-1).
Ceci provient d'une très faible ionisation, c'est à dire de la dissociation en ions H+ et OH- (voir les propriétés chimiques).
Notes sur la supraconductivité > page interne.
- Constante diélectrique (Permittivité e , relative à celle du vide, e0 = 8.854.10-12 A2. s4. kg-1. m-3 ou 8.854 picoFarad par m [pF m-1]) : une des plus élevée > 80 F m-1 à 20°C (dans un champ électrique appliqué - statique - de fréquence 35 kohms). Notes sur le Farad > lien interne.
(constante diélectrique de l'eau en fonction de la température)Au niveau microscopique, la permittivité d'un matériau est liée à la polarisabilité électrique des molécules ou atomes constituant le matériau. Pour l'air e = 1 A2. s4. kg-1. m-3 ou 1 F m-1
Ceci explique le fort pouvoir ionisant de l'eau sur les autres substances (dissolution).
Propriétés optiques.
- Vitesse de la lumière dans l'eau (pure à 25°C) : 224 984,9 km/s (sous P =1 atm), soit environ 24,9 % moins rapide que dans l'air et dans le vide ( air : 299 704,6 km/s, vide : 299 792, 458 km/s).
Nota : dans l'eau de mer de salinité 35 g/L (et à 25°C) : environ 223 860,6 km/s, soit 0.5% moins rapide que dans l'eau pure.
A noter qu'il est possible qu'une particule donnée voyage plus vite que la lumière dans un milieu donnée, c'est à dire plus rapidement que la vitesse de la lumière dans ce même milieu : c'est l'effet Cerenkov.
C'est un rayonnement de couleur bleu que l'on l'observe en particulier dans les centrales nucléaires (où il est responsable de la couleur bleue des piscines) :
Cet effet est utilisé dans les détecteurs en physique des particules en accélérateurs, ou dans des détecteurs pour les astroparticules comme H.E.S.S et AUGER.
Mais, la vitesse de la lumière dans le vide reste toujours supérieure à celle du rayonnement Cerenkov ! (soit, 299 792 458 ou 2,9 108 m/s).
-----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Nota > science facile : mesurer (approximativement) la vitesse de la lumière dans l'air avec des objets du quotidien, tels qu'une tablette de chocolat et un four à micro-ondes ?
Voici la marche à suivre :
1 - En premier, il faut surélever le plateau tournant du four à micro-ondes au-dessus du mécanisme, par exemple à l'aide de petits pots en verre.
Puis posez-y une tablette de chocolat. Faites chauffer suffisamment pour que le chocolat commence à fondre mais pas trop pour éviter que la tablette ne fonde entièrement.
2 - En sortant la tablette de chocolat du four à micro-ondes, vous verrez apparaître des zones fondues et d'autres encore dures.
D'un four à l'autre, les mesures peuvent être légèrement différentes mais, en moyenne, les zones fondues sont espacées de quelque 6,5 centimètres (0,065 m).
3- Or, ce qui permet de chauffer les aliments à l'intérieur d'un four à micro-ondes, c'est l'énergie transportée par les ondes électromagnétiques qui circulent dans la cavité du four.
La répartition de cette énergie selon une certaine direction présente une période égale à une demi-longueur d'onde. Selon la théorie donc, la distance entre deux régions fondues de la tablette de chocolat est égale à la longueur de l'onde électromagnétique divisée par deux.
La vitesse de la lumière - qui est aussi la vitesse à laquelle se propagent les ondes électromagnétiques - est donnée par la relation suivante :
c = g x f , avec,
- c, la vitesse de la lumière (m/s)
- g, la longueur d’onde (m)
- f, la fréquence (Hz)
La fréquence est donnée sur l'étiquette collée à l'arrière du four à micro-ondes, et la longueur d'onde a été mesurée plus haut comme deux fois la distance entre deux portions fondues.
4 - Avec par exemple, f = 2,45.109 Hz, et g = [2 x 0,065] m, on obtient pour la vitesse de la lumière dans l'air : cair = 318 500 000 ou 3,185.108 m/s .
(NB : cair réel = 299 704,6 km/s ou 299 704 600 m/s, ou environ 2,99.108 m/s)
La valeur ainsi déterminée est donc assez proche de la réalité.
(soit, une différence de 6% en plus environ)
----------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Absorption de la lumière : l'eau absorbe préférentiellement le rouge, ce qui explique que cette couleur disparaisse progressivement de la lumière ambiante au fur et à mesure que la profondeur augmente.
> Indice de réfraction : l'indice de réfraction moyen de l'eau est d'environ 4/3,soit, et il varie notamment en fonction de la température et de la pression,
soit pour l'eau pure : 1.3339 à 0°C, 1,3337 à 10°C, 1,3330 à 20°C, 1,3325 à 25°C (avec raie D du sodium de longueur d'onde g =589,29 nm , sous P= 1013,25 hPa).
> vapeur d'eau > 1.00026
> l'air (atmosphère terrestre dans les conditions normales de température et de pression [CNTP] à 0 °C et 1 atm) = 1,000293.
NB : en toute rigueur, cet indice dépend de la couleur. L'eau est un milieu dispersif comme les autres et c'est précisément cette dépendance qui est à l'origine du phénomène connu sous le nom d'arc en ciel.
Nota >>> voir ou revoir éventuellement, les pages sur l'optique aquatique.
En fait, l'eau n'est jamais pure, et il faut aussi tenir compte de la diffusion et de la direction de propagation (biréfringence).
L'eau est une substance
très stable qui peut être formée par une
réaction exothermique (dégagement de chaleur),
soit :
La
réversibilité de cette réaction n'est possible
qu'à haute température (entre
2000 et 3000 K), ou par
des réactions secondaires d'électrolyse d'acides ou de
bases, et également par certaines radiations.
L'oxygène de l'eau peut être déplacé par
les éléments électronégatifs (fluor) ou
électropositif, l'hydrogène est déplacé
par les métaux (Fer vers 800°C) ou sur du carbone
incandescent, mais également à froid avec les
métaux alcalins (sodium, potassium)
La molécule H2O peut aussi se détruire par
le phénomène d 'hydrolyse : décomposition
chimique d'un corps par action de l'eau.
Exemples :
- le chlorure de fer FeCl3 régit avec l'eau pour
former de l'oxyde ferrique Fe(OH)3et de l'acide
chlorhydrique
- l'urée CO(NH2)2,
composé organique, se transforme en carbonate d'ammonium
(NH4)2CO3
- les carbures
métalliques donnent avec l'eau des
hydrocarbures.

Les réactions d 'hydratation : fixation de la molécule d'eau sur un corps, avec formation d'une nouvelle combinaison. De nombreux sels cristallisés possèdent ainsi de l'eau, sous forme H2O lié :
MgSO4, 7H2O - Al2(SO4)3, 18H2O - CuSO4, 5H2O... etc....
L'eau combinée, par exemples dans les substances hydroxydes tels que la chaux
Ca(OH)2 ou la soude NaOH.
L'eau entraîné mécaniquement dans un cristal (humidité) : sous cette forme elle est facilement enlevée par dessiccation.
L'action catalytique de l'eau : de nombreuses réactions chimiques nécessitent la présence de H2O, par exemple l'ammoniac NH3 et l'acide chlorhydrique HCl ne donnent pas de chlorure d'ammonium (fumées blanches) si l'air est très sec.
De même le fer ne "rouille" pas si l'air ne contient pas un peu d'humidité...Cas particulier - hydratation de l'oxygène : on obtient de l'eau oxygénée [ H2O2 ]
> voir éventuellement les pages internes sur H2O2.
NOTA > Canulars chimiques classiques rencontrés :
- OH2 est un oxyde, le monoxyde de dihydrogène...
- l'eau est un hydroxyde du type H-OH, donc on peut dire l'hydroxyde d’hydrogène...
- un acide HO-H : l’acide oxhydrique (ou hydroxyque)...
 Ionisation
Ionisation

L'eau
pure est
peu conductrice du courant - voir résistivité
électrique - elle est légèrement
dissociée par la réaction d'équilibre
exothermique suivante (cette
dissociation électrolytique est fonction de la
température)
:
Les double flèches indique que la réaction
s’effectue dans les deux sens. Dans l’eau, il y aura
toujours à la fois des molécules non-dissociées
H2O et des
ions H+
et OH-
Il y a donc à la fois dissociation et recomposition, ceci
conduit à un équilibre appelé équilibre
de dissociation de l’eau (ou de protolyse de
l'eau) .
Egalement, l'eau se comporte soit comme un acide puisqu'il est
susceptible de libérer H+
(ci-dessus), soit comme une base car peut accepter
H+
:
c'est donc un ampholyte (ou
amphotère > substance ayant des fonctions acide ET
basique).
En fait, il y a
autoprotolyse
de l’eau (une
autoprotolyse est une réaction de transfert de proton entre
deux molécules identiques, l'une jouant le rôle d'acide
-au sens de Bronsted- et l'autre celui de
base) : dans toute
solution et même dans l’eau pure, des molécules
d’eau (H2O)2 liées via une liaison
hydrogène, réagissent en permanence pour donner
naissance à des ions H3O+ et
OH- :
Inversement, dans toute solution et même dans l’eau pure, des ions H3O+ et OH- réagissent en permanence pour donner naissance à des molécules H2O :
Globalement, il existe dans toute solution aqueuse (y compris l’eau pure) un équilibre entre ces trois sortes d’espèces.
Nota : Les ions H3O+ et OH- ainsi formés sont immédiatement solvatés (hydratés).
Le coéfficient d'ionisation étant très faible,
on peut considérer que [H2O] est constante
et égale à 55,509, et rappelons que la constante
Kc définissant le produit ionique de l'eau
(équation de la
loi d'action de masse)
est Kc= [H3O+]
[OH-] / [H2O]
donc la constante de
dissociation de l'eau Ke qui
caractérise l'état d'équilibre de la
réaction,
Ke = 55,509
Kc
et Ke = [H3O+]
[OH-] = 10-14moles/l
à 24°C
(sous la pression
atmosphérique "normale" de 1 013,25
hPa),
et donc CH
= COH
= 10-7
moles/l , ou CH3O+
= COH
= 10-7. -log [H3O+]
Nota :
1 > cette constante Ke de l'eau pure dépend donc
de la température T en °C
:
(Larson &
Buswell) - (
[H3O+] et
[OH-] en mole/L
)
Rappel : pH = -log
[H3O+]
et pOH = -log[OH-]
2 > mais
également de la pression (rappel
1 atm = 1013,25
hPa =
0,10133
MPa) :
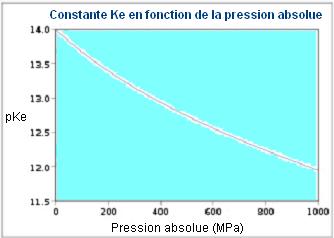
3 > pour l'eau non
pure pKe dépend de l'activité dûe à la
force ionique, elle-même fonction de la minéralisation
(sels dissous), d'ou pK'e
>>> ci-joint un graphique montrant la variation du pK'e
enfonction de la température et du RS (Résidu Sec,
180°C) :
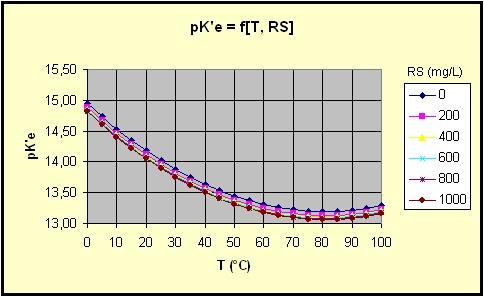
Comme un litre d'eau pure (non dissociée, à 24°C) contient [H2O] = 1000/18,0153 = 55,509 moles, il n'existe donc à peu près qu'une molécule dissociée sur 555 000 000 (à 24°C), et environ 1 sur 236 800 000 à 50°C !
NOTES : la radiolyse de l'eau (par un flux de rayonnement hu) peut induire un exédent d'énergie des molécules d'eau et conduire à une ionisation de ces molécules :
on obtient l'ion radical
H2O.+ (le
point en bas symbolise l'électron non aparié,
célibataire) et un
électron e-, d'énergie cinétique
Ec.
Nota : la molécule peut se retrouver dans un état
éxcité, sans être ionisée :
hu
+ H2O >>> H2O*
(le * symbolise
l'état d'éxcitation d'un atome ou d'une
molécule).
Les molécules ainsi ionisées ou excitées sont
instables (10-12
s de durée de vie)
et se dissocient elle-même en d'autres radicaux :
Ces nouveaux radicaux libres
HO. et H. sont de grande réactivité chimique, mais
également de durée de vie très brèves
(10-9s)
et ils ne pourront migrer que sur de courtes distances (env. 25
nm).
Il vont s'annihiler ou former de nouvelles molécules
:
Par ailleurs, l'électron e- se stabilise pour donner un électron thermique e-th, lequel s'entoure d'une cage de de molécule d'eau pour former un électron hydraté appelé électron aqueux e-aq :
Nota : les molécules
entourant l'électron aqueux peuvent également se
dissocier en radicaux H. et
HO.
Toutes ces étapes se produisent en moins de 10-6s,
et finalement les produits résultants présent dans
l'eau sont H2O2, H. , HO. et e-aq. A
noter que ces produits sont toxiques à cause de leurs
réactivité, mais aussi pour certains tels que
H2O2 et HO. pour leur pouvoir oxydant.
En présence dans l'eau d'oxygène
moléculaire O2,
on peut observer la formation de radicaux qui amène une
augmentation de l'effet oxydant :
L'eau est elle-même
l'un des agents ionisants les plus importants. Comme la plupart des
substances sont solubles dans l'eau, on l'appelle fréquemment
"le
solvant
universel". L'eau s'allie
avec certains sels pour former des hydrates et réagit avec des
oxydes de métaux pour former des acides. Elle est
utilisée comme catalyseur dans de nombreuses réactions
chimiques importantes.
Exemple :
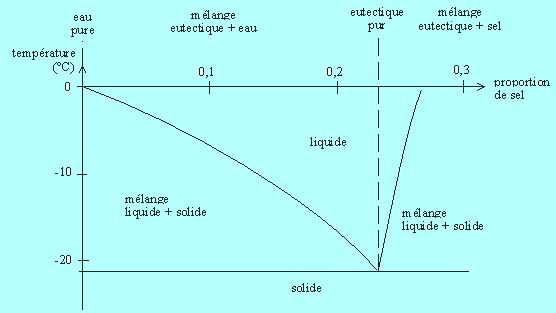
Rappel : un eutectique est un mélange de deux corps purs qui fond et se solidifie à température constante, contrairement aux mélanges habituels. Il se comporte en fait comme un corps pur du point de vue de la fusion.
|
|