Diagramme des phases
Gaz<>liquide
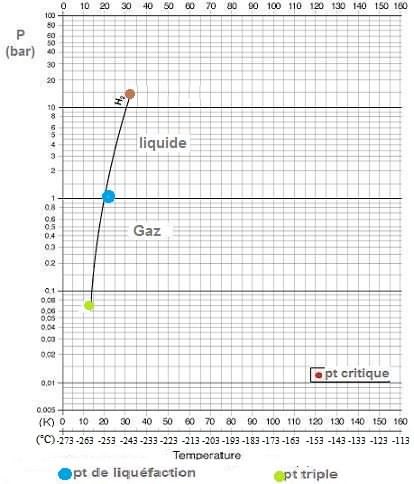
Diagramme de phases gaz/liquide/solide
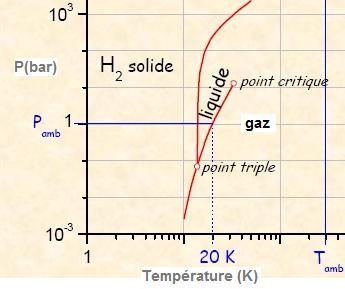
(Pamb et Tamb : pression et température ambiante)
GÉNÉRALITÉS
:
L'hydrogène gazeux ou
dihydrogène est le résultat de la combinaison de
deux atomes d'hydrogène H, soit la molécule de
formule H2 (aux conditions normales
de température et de pression).
L'hydrogène est
l'élément le plus abondant de l'Univers : 75
% en masse et 92 % en nombre d'atomes.
Les nuages d'hydrogène sont à la base du processus de
la formation des étoiles.
Il a donc un rôle vital dans l'Univers par
l'intermédiaire des réactions proton-proton et du
"cycle de Bethe" (cycle catalytique CNO :
carbone-azote-oxygène), qui sont deux voies de
réactions de fusion thermonucléaire qui créent
d'énormes quantités d'énergie en combinant
quatre atomes d'hydrogène pour former un atome
d'hélium. Il est le principal constituant du Soleil
(75% en masse) et de la plupart des
étoiles et nébuleuses.
Dans la croûte terrestre, l'hydrogène représente
0,22 % des atomes, loin derrière l'oxygène (47 %) et le
silicium (27 %).
Par ailleurs, il représente 0,55 ppmv (en
volume) des gaz atmosphériques.
Il est surtout le principal constituant (en nombre
d'atomes) de toute matière vivante, associé au
carbone dans tous les composés organiques. Par exemple,
l'hydrogène représente 63 % des atomes et 10 % de la
masse du corps humain.
Masse atomique de l'atome H : 1,00794 ± 0,00007 u
Masse molaire de
1H2
: 2,01588 ± 0,00014 g
mol-1 (H 100
%).
Isotopes les plus connus de l'atome H :
Nota : un atome de tritium est présent pour 1018 atomes d’hydrogène; le quadrium est l'isotope le plus instable de l'hydrogène, à émission de neutron.
Sur Terre, l'hydrogène est généré
à partir des hydrocarbures (pétrole et
ses dérivés), et à partir de l'eau dont
les molécules sont composées de deux atomes
d'hydrogène et d'un atome d'oxygène [
H2O ] ; mais la plupart
des matières organiques, comme celle qui constitue les
êtres vivants, le pétrole et le gaz naturel, sont des
sources d'hydrogène
(le méthane CH4 qui est un produit de la
décomposition des matières organiques, est de plus en
plus utilisé comme source d'hydrogène > lien
interne sur le méthane).
Il est également présent dans de nombreuses
molécules : sucre, protéines, hydrocarbures.
Nota : À très basse pression et très haute
température l'hydrogène est un gaz monoatomique
(donc de formule H), c'est notamment le cas du
gaz interstellaire ou intergalactique. En raison de
l'immensité de ces espaces et malgré la très
faible densité du gaz, l'hydrogène monoatomique
constitue près de 75 % de la masse baryonique de
l'univers.
Chimie de l'hydrogène.
L'hydrogène se combine avec la plupart des autres
éléments car il possède une
électronégativité moyenne
(2,2) et peut ainsi former des composés
avec des éléments métalliques ou
non-métalliques.
Les liaisons que l'atome d'hydrogène H peut établir
peuvent être de trois sortes :
Propriétés de l'hydrogène diatomique
H2.
L'hydrogène est un un gaz incolore, inodore et
extrêmement inflammable.
Aux conditions "normales" de pression, c'est un gaz beaucoup plus
léger que l'air : Masse volumique (Mv) = 0,08988
g/L-1 (gaz, CNTP, 1013,25 hPa et 0
°C).
Il se liquéfie à T =
-252,87°C (20,28 K), sous P = 1atm, et
> Mv = 0,0708 kg·L-1
(liquide).
C'est certainement aussi le point d'ébullition de
l'hydrogène liquide.
Le point de solidification de
l'H2 liquide serait de
-259,14 °C (14,01 K), et > Mv = 0,0706
kg·L-1 (donc solide, à -262
°C);
et donc c'est aussi pratiquement le point de fusion de H2
solide.
L'hydrogène métallique est une phase de
l'hydrogène survenant lorsqu'il est soumis à une
très forte pression (3,5 à 4,2 millions
d'atm !) et à de très basses
températures. C'est un exemple de matière
dégénérée.
Le point triple se situe à T = -259,3°C
(13,7 K) et P = 72,05 hPa (72
mbar), et se trouve bien inférieur à la pression
atmosphérique ("normale" à 1013,25 hPa
ou 1013 mbar), donc l'hydrogène
liquide (et solide) ne peut exister aux
pressions et températures classiques sur la Terre.
Le Point Critique se situe à Pc = 1, 298 MPa (
12,98 bar ) et Tc = -240°C
[33 K] .
La combustion de H2
avec l'oxygène O2, qui produit de l'eau, est
particulièrement violente et très exothermique : son
pouvoir calorifique est de 141,86 MJ kg-1
(39,41 kWh kg-1) contre, par
exemple, seulement 49,51 MJ kg-1 (13,75
kWh kg-1) pour le butane
C4H10 (i.e. 1,86 fois plus important).
Cette propriété en fait un carburant de choix pour
les engins spatiaux mais rend son stockage dangereux. La
même oxydation plus lente est utilisée pour produire du
courant électrique dans les piles à
combustible.


Quelques caractéristiques :
Utilisation.
Divers.
Température
d'auto-inflammation dans l'air : 560
°C (833 K).
Limites d'inflammabilité dans l'air
(conditions normales TPN) : 4 -75 % vol
Le stockage gazeux sous forme comprimé
(actuellement 350 bars ou 35 MPa) permet
d'atteindre une densité massique satisfaisante avec des
réservoirs composites.
La densité volumique de stockage reste faible : une pression
de 700 bars (70 MPa) est nécessaire
pour rendre la technologie compétitive.
Le stockage liquide à -253°C (20
K) sous 10 bars (1 MPa) permet
d'atteindre des densités volumique et massique
intéressantes mais nécessite des réservoirs
à l'isolation thermique afin de minimiser
l'évaporation.
Effet sur l'homme.
H2 n'est pas un gaz toxique mais asphyxiant.
Lien
sur la sécurité (fichier
pdf).
Téléchargement des
Fiches Techniques de Sécurité
- Air
Liquide
(fichiers
pdf) : H2
comprimé et
H2
liquide
(réfrigéré).