GÉNÉRALITÉS
:
L'oxygène gazeux ou
dioxygène est le résultat
de la combinaison de deux atomes d'oxygène O, soit la
formule moléculaire O2 , ou O=O;
(aux conditions normales de température et
de pression)
Masse atomique de
16O :
15,9994 ± 0,0003 u (atome O).
Masse molaire de
16O2 :
31,9988 g mol-1.
Isotopes : 13, dont 3 stables > 16O
(99,762 % d'Abondance Naturelle),
18O (0,2 % d'AN), et 17O
(0,038 % d'AN);
et 14O, 15O et 19O, 20O ,
radioisotopes synthétiques de courtes
périodes (n'existe pas pas à
l'état naturel).
Nota : l'isotope 18 est utilisé pour
connaître la température dans une région à
un moment donné (plus le rapport isotopique
18O / 16O est élevé, et plus la
température correspondante est basse).
Autres allotropes : Ozone O3, oxygène singulet
O2*, ozone cyclique O3,
tétraoxygène O4, octaoxygène
O8 .
NB : l’allotropie (du grec allos autre et
tropos manière) est, en chimie, en minéralogie
et en science des matériaux, la faculté de certains
corps simples d’exister sous plusieurs formes cristallines ou
moléculaires différentes.
C'est, en masse, le troisième élément le plus
abondant de l'Univers après l'hydrogène et
l'hélium.
Par ailleurs, le gaz oxygène O2 sur
Terre, représente 23,1% de la masse de l'air, sous forme
de dioxygène O2 et d'ozone O3, soit
1,2.1015 tonnes environ,
(20,95 % du volume total de
l'atmosphère terrestre, voir ce
lien sur l'air).
L'élément oxygène O représente
environ :
- 88,8 % de la masse des océans,
- 46,4 % de la masse de la croûte terrestre, en
particulier sous forme d'oxydes et de silicates,
- 62,5 % de la masse du corps humain,
- jusqu'à 88 % de la masse de certains animaux
marins.
L'oxygène gazeux (O2) est
indispensable au cycle de la vie : les végétaux
dégagent du dioxygène par photosynthèse alors
que la respiration des animaux et des plantes en consomme.
De plus, l'oxygène est un composant essentiel des
molécules qui se retrouvent dans tout être vivant:
acides aminés, sucres, etc.
Il n'est en revanche pas nécessaire à certaines
bactéries dites anaérobies facultatives, et est mortel
pour les bactéries anaérobies strictes.
Rappel : c'est la photosynthèse qui maintient constant le taux
d'oxygène O=O dans l'atmosphère terrestre et fournit
toute la matière organique ainsi que l'essentiel de
l'énergie utilisées par la vie sur Terre. Ce processus
bioénergétique permet aux plantes, aux algues et
à certaines bactéries, dites photoautotrophes, de
synthétiser de la matière organique en utilisant la
lumière du soleil. Des glucides, par exemple des oses tels que
le glucose, sont synthétisés à partir du
CO2 et de l'eau H2O avec libération
d'oxygène O2 comme sous-produit de l'oxydation de
l'eau.
Plusieurs hypothèses ont été
avancées pour expliquer sur Terre, la teneur de l'air en
O2 :
- la plus communément retenue est qu'il s'agit du
déchet produit jadis par les algues
bleues, extrayant le carbone du dioxyde de carbone et
rejetant l'oxygène (sous forme
O2),
- également, la décomposition en altitude depuis
des millions d'années, de molécules d'eau en
O2 (et dihydrogène
H2) sous l'effet des rayonnements solaire et
cosmique. Le dioxygène est en effet retenu par la
gravitation terrestre, ce qui n'est pas le cas de
H2,
- enfin, l'oxygène aurait été
libéré du manteau terrestre qui se refroidissait il
y a 2.5 milliard d'années, puis la mise en route du
processus de la tectonique des plaques (à
la transition entre l’Archéen et le
Protérozoïque). Un régime de convection
du magma se serait alors installé libérant
l'excés d'O2 initialement piégé dans le magma
profond (Observatoire de Physique du Globe de
Clermont-Ferrand, OPGC).
La consommation d'oxygène est un indice
d'activité cellulaire. Ce fait est à l'origine d'une
caractérisation de la pollution biodégradable
d'un échantillon d'eau, la demande biologique en
oxygène ou DBO (voir ce lien
interne).
Il participe à des réactions
d'oxydo-réduction, essentiellement dans la combustion
et la corrosion.
Le dioxygène est un corps paramagnétique
(il est attiré par un aimant). Cette
propriété est due à la présence de deux
électrons non-appariés dans sa structure
électronique.
Nota : l'oxygène monoatomique est très
électronégatif. Il forme facilement de nombreux
composés ioniques avec les métaux (oxydes, hydroxydes).
Il forme aussi des composés ionocovalents avec les
non-métaux (exemples : le dioxyde de carbone, le trioxyde de
soufre) et entre dans la composition de nombreuses classes de
molécules organiques, par exemple, les alcools (R-OH), les
carbonylés R-CHO ou R2CO et les acides carboxyliques
(R-COOH).
État(s) d'oxydation -2, -1 .
Propriétés de l'oxygène diatomique
O2 ou dioxygène.
- L'oxygène est un un gaz incolore, inodore et
insipide.
C'est un gaz très réactif et à cause de son
indice d'électronégativité
élevé (5), il réagit avec l'ensemble des
éléments du tableau périodique
(à l’exception des gaz rares)
et beaucoup de composés, pour former des oxydes.
Exemple : combustion de l'heptane dans un moteur d'automobile,
- C7H16 +
4O2 > 7C +
8H2O
2C7H16 +
15O2 >
14CO +
16H2O
C7H16 +
11O2 >
7CO2 +
8H2O
Les deux premières réactions produisent
respectivement du carbone et du
monoxyde de carbone CO. Le
carbone formé à l'intérieur du moteur forme
des dépôts sur la calotte et les pistons. Le monoxyde
de carbone contenu dans les gaz d'échappement est
très dangereux pour la santé.
------------------------
Aux conditions "normales" de pression (à
1013,25 hPa et 15 °C), c'est un gaz plus lourd que
l'air : 1,354 kg/m3.
Solubilité dans l'eau :
Solubilité de l’oxygène de l’air dans
l’eau. Elle est déterminée à la pression
atmosphérique, sous la pression partielle de
l’oxygène de l’air (qui contient donc 20,9 %
d’oxygène en volume, soit
PO2= 0,209 bar ou 209 hPa) et en
fonction de la température.
et :
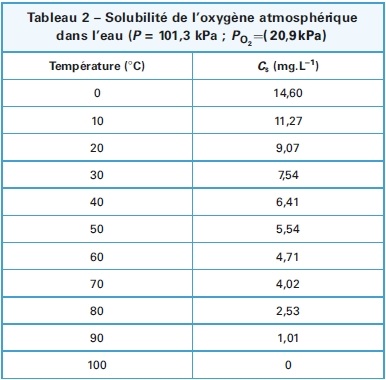
Rappel : 1 kPa = 10 hPa)
--------------------------------------------------------------------------------------------------------------------------------------
NOTA : au niveau de la mer, on peut appliquer avec suffisamment
de précision ce polynôme du second degré
(valable entre 0 et 30°C) :
Cs = 14,6 - 0,3818 t + 0,00488
t²
avec Cs concentration en O2 dissous à
saturation sous la pression atmosphérique (en
mg·L- 1) et t
température (en °C).
Par ailleurs, une excellente approximation peut également
être obtenue à partir de la formule de
Mortimer (1981) qui présente
l’avantage de s’appliquer entre 0 et 50°C :
Cs = 2234,34 (t +
45,93)-1,31403
Et avec les formules de Gameson et Robertson :
Eau "douce" > Cs = (468,41 /
(31,64+t))
Eau salée > Cs = (475 - (2,65s))
/ (33,5 + t)
......(avec
s = salinité en g/L et
t entre 3 et 25°C
)..........
Téléchargement
d'une feuille de tableur pour calculs de la teneur en
oxygène
> ici
--------------------------------------------------------------------------------------------------------------------------------------
Il se liquéfie à T = -183 °C
[90 K] (P =
1atm). C'est aussi le point d'ébullition de
l'oxygène liquide.
Le point de fusion de l'O2 solide
(oxygène congelé) est de -219 °C
(54 K), et donc c'est aussi le point de
solidification de l'O2 liquide.
Le point triple se situe à T = -218,8 °C
(54,35 K) et Pression = 1,52 hPa
(1,52 mbar), et se trouve bien
inférieur à la pression atmosphérique
("normale" à 1013,25 hPa ou 1013
mbar), donc l'oxygène
liquide (et solide) ne peut exister
aux pressions et températures classiques sur Terre.
Le Point Critique se situe à Pc = 5,043 MPa
( 50,43 bar ) et Tc = -118,6
°C [154,55 K]
.
------------------------------
Diagramme des phases
Diagramme des phases gaz/liquide :
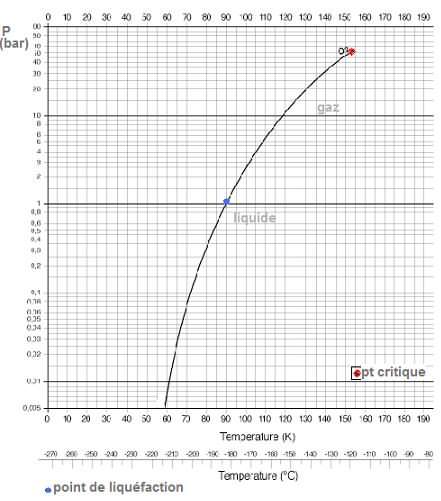
Diagramme des phases liquide/solide :

Dans son état triplet normal, la molécule de
dioxygène est paramagnétique, c'est-à-dire
qu'elle acquiert une aimantation sous l'effet d'un champ
magnétique.
L'oxygène liquide par exemple peut être attiré
par un aimant !
Quelques caractéristiques :
- Phase gazeuse :
- Masse volumique de la phase gazeuse
(1013,25 hPa, à 15 °C ) :
1,354 kg.m3-1 , et 1,42763
kg·Nm-3 T.P.N.
Nota : en chimie, la température et la pression normales
(TPN) sont 1 013,25 hPa et 0 °C (ou 273 K)
- Équivalent gaz/liquide (1013,25
hPa et 15 °C) : 1 m3 de gaz
(1,36 kg) > 1,17 litre de
liquide
- Volume spécifique (1013,25 hPa,
à 21 °C ) : 0,755 m3 kg-1
- Chaleur spécifique à pression constante (Cp)
(1000 hPa et 25
°C) : 29 J/(mole.K)
- Viscosité (1013,25 hPa, à 0
°C ) : 0,0001909 Poise
- Conductivité thermique (1013,25 hPa,
à 0 °C ) : 24,24 mW/(m.K)
- Phase liquide :
- Liquide bleuté
- Masse volumique de la phase liquide
(1013,25 hPa, au point
d'ébullition) : 1141 kg
m3-1
- Équivalent liquide/gaz (1013,25
hPa et 15 °C) : 1 m3 d'O2 liquide >
854 m3 de gaz [1156,3 kg] )
- Point d'ébullition (1013,25
hPa) : -183 °C (90 K)
- Chaleur latente de vaporisation (1013,25
hPa, au point d'ébullition de -183 °C) :
212,98 kJ kg-1
- Phase solide (oxygène congelé) :
- Point de fusion : -219 °C (54
K)
- Chaleur latente de fusion (1013,25
hPa, au point triple) : 13,9
kJ/kg
Normalisation.
Norme sur les produits utilisés pour la production
d’eau potable : bulletin
officiel - Oxygène : pr NF EN 12876.
Utilisation.
- Industrielle :
- provoquer des réactions chimiques (industrie du fer
et de l'acier, oxydation de certains matériaux,
fabrication d'ozone pour l'oxydation ou le nettoyage,
blanchiment, craquage catalytique en raffinerie,
- comburant (par exemple : propulsion des
étages cryogéniques des fusées
Ariane),
- tout procédé de combustion à
l'oxygène,
- calibrage les analyseurs et détecteurs de
sécurité, analyseurs de contrôle de
l'environnement, analyseurs de contrôle des
atmosphères de travail,
- purification biologique de l'eau, incinération
propre des déchets,
- activation de flamme des chalumeaux oxhydriques.
- Médicale :
- oxygénothérapie normobare
(à pression atmosphérique)
: dans l'assistance respiratoire de personne ayant des
difficultés respiratoires (maladie telle
que l'asthme ou l'insuffisance respiratoire chronique, ou lors
d'une anesthésie), pour la ventilation
artificielle (arrêt de la
respiration),
- oxygénothérapie hyperbare
(à haute pression) : pour le
traitement de certaines intoxications au gaz
(notamment au monoxyde de carbone), des
accidents de décompression en plongée ou de
certaines brûlures, de certaines pathologies
artéritiques.
Divers.
L'exposition prolongée au feu
des récipients peut entraîner la rupture et
l'explosion.
Effet sur l'homme.
L'inhalation continue de concentrations supérieures à
75% peut causer des nausées, des étourdissements, des
difficultés respiratoires et des convulsions.
Téléchargement des
Fiches Techniques de Sécurité
- Air
Liquide
(fichiers
pdf) : O2
comprimé et
O2
liquide
(réfrigéré).
 (utilisez votre navigateur)
(utilisez votre navigateur)


