 Une
épuration biologique et une transformation chimique se feront
donc progressivement à mesure que l'on s'éloignera de
la surface !
Une
épuration biologique et une transformation chimique se feront
donc progressivement à mesure que l'on s'éloignera de
la surface !
Une telle eau, mise en présence d'acide sulfurique
(résultant de l'oxydation des pyrites), s'enrichira en sulfate
ferreux, bicarbonate ferreux et sulfate de sodium.
Ces deux exemples montrent une des caractéristiques
fréquentes des eaux souterraines qui est leur forte teneur
en fer.
Certaines roches, telles les zéolithes, sont douées de
propriétés d'échange d'ions. Une eau
chargée en sels de calcium, mise en contact avec des roches
zéolithiques échangera ses ions Ca++ contre
des ions Na+
On comprend donc pourquoi on peut, dans un même lieu,
suivant le trajet de l'eau dans le sous-sol, avoir des types d'eau
différents.
Le volume des eaux qui s'infiltrent dans le sol dépend,
évidemment de l'abondance des précipitations, mais,
tout aussi évidemment de la texture du sous-sol.
Généralement, les roches ne sont pas absolument
compactes mais présentent des pores ou des fissures. Les
roches présentent donc une faculté plus ou moins grande
à se laisser pénétrer par l'eau.
On peut diviser les terrains, du point de vue hydrogéologique
en deux grandes catégories :
Les terrains totalement imperméables sont
pratiquement uniquement constitués par l'argile. Encore
faut-il qu'elle soit suffisamment comprimée. Ce type de
terrain peut s'imprégner d'eau (jusqu'à 50% de
porosité), mais la finesse des particules d'argile ne permet
pas la circulation de cette eau.
Les limons présentent des propriétés voisines de
l'argile.
Les marnes sont également imperméables mais peuvent
présenter des fissurations permettant la
pénétration de l'eau dans les couches
sous-jacentes.
Les terrains perméables se subdivisent à leur
tour en deux types :
NAPPES.
Selon la profondeur à laquelle s'établit la
nappe (altitude du substratum imperméable), les nappes
aquifères ainsi formées sont le siège d'une vie
aérobie ou anaérobie qui minéralise les
matières organiques.
Dans une nappe aquifère, l'eau circule très lentement
et tend à s'écouler vers certains points où elle
peut apparaître en surface, formant des sources.
Une nappe aquifère idéale se présente ainsi
:
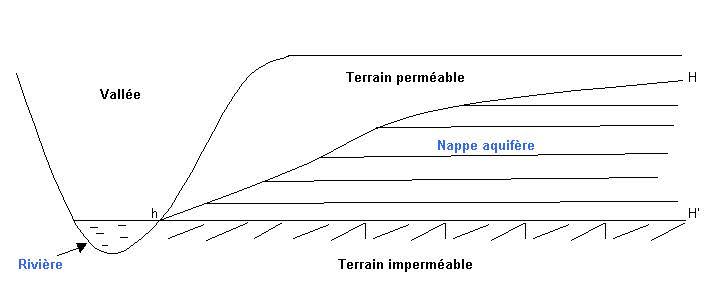
h étant le niveau d'une rivière de vallée (ou la
mer), l'eau de pluie pénètre jusqu'au niveau h H. La
pente h H est d'autant plus grande qu'elle est plus
éloignée de la mer, puis devient horizontale.
Entre h H et la couche imperméable h H' se situe la nappe
aquifère dans laquelle les roches sont
imprégnées d'eau à un tel point que la
porosité est annulée. Dans cette zone, l'eau
circule.
La surface h H est définie par le rapport du débit
d'alimentation au débit d'écoulement. Ces débits
sont évidemment variables dans le temps. L'alimentation de la
nappe dépend surtout de la pluviosité, du climat et de
la végétation.
La vitesse d'écoulement dépend de la porosité du
sol, moins tassé en surface, il permet un écoulement
plus facile.
En conséquence, la ligne h H épouse, en
l'atténuant, le relief du sol de surface. Cette ligne peut
subir des variations en altitude en raison de la variation du rapport
débit d'alimentation/débit d'écoulement.
On appelle cette ligne niveau hydrostatique ou surface
piezométrique.
La variation du niveau hydrostatique explique pourquoi certaines
sources tarissent en saison sèche. Elle permet aussi de
comprendre pourquoi l'on s'efforce, lors du forage d'un puits,
d'atteindre la couche imperméable.
Une nappe telle que décrite ci-dessus est une nappe
libre.
Si, à partir de son affleurement, la couche perméable
plonge sous une couche imperméable, cette dernière
forme un toit au-dessus de la nappe qu'il maintient en pression,
la nappe est dite alors captive.
Si cette pression est suffisante, elle permet à l'eau de
jaillir au-dessus du niveau du sol lorsque l'on fore un puits dans le
toit. Ce puits prend alors le nom de puits artésien (de
l'Artois où ce genre de nappe est fréquent).
En surface (au-dessus de la ligne h H), se trouve une autre nappe
dite phréatique ou des puits. Elle est toujours libre.
Le cas que nous avons considéré est, nous l'avons dit,
idéal en ce sens que la couche imperméable est
constituée par un sol parfaitement horizontal (ligne h H').
Pratiquement, le sous-sol a une structure beaucoup plus complexe et
tourmentée.
La forme de la nappe (niveau h H) est alors déterminée
par la forme de la couche imperméable. De plus, l'alternance
de couches perméables et imperméables peut
déterminer, à chaque fois, une nouvelle nappe
aquifère.
Ce schéma peut encore être compliqué par la
présence de failles, plissements et dislocations qui peuvent
canaliser ou compartimenter l'eau de la nappe. C'est pourquoi il est
important, en hydrogéologie, de bien connaître la
tectonique du sous-sol, c'est-à-dire sa structure.
SOURCES.
On peut distinguer les sources vraies et les fausses
sources.
Les fausses sources sont des émergences d'eau en
terrain calcaire.
Elles peuvent être :
Les vraies sources qui sont issues de terrains perméables en petit.
PROPRIÉTÉS
SPÉCIFIQUES DES EAUX
SOUTERRAINES.
En dehors des nappes phréatiques évidemment
très exposées aux pollutions, les eaux profondes
présentent généralement une bonne qualité
du point de vue bactériologique.
Il convient toutefois de se méfier de certaines eaux
souterraines qui circulent en terrain karstique. Ces terrains,
perméables en grand, présentent des fissures agrandies
par le passage des eaux.
La dissolution des roches calcaires par le gaz carbonique de l'eau a
crée des grottes et des siphons (provoquant le
phénomène des sources intermittentes).
Dans ces grottes, le bicarbonate de calcium - Ca
(HCO3)2 - dissout dans l'eau se
décompose au contact de l'air :
Il y a donc formation de carbonate de calcium
(lien > CaCO3
), de gaz carbonique (lien >
CO2
) et d'eau.
Le CaCO3 cristallise et forme stalactites et
stalagmites*, tandis que le CO2 stagne au ras du sol en raison
de sa densité supérieure à celle de l'air. Ce
CO2 n'est pas toujours sans danger : la Grotte
du Chien à Royat (à 3 km de
Clermont-Ferrand) et surtout le lac Nyos
(Cameroun).
*Rappel : stalactites = colonne de calcaire
descendant vers le sol - stalagmites = colonne montante formée
par dépot de calcaire.
L'eau circulant à la façon d'une rivière ne
subit aucune filtration. De plus, des cratères
(abîmes, avens, gouffres, betoires selon les
régions) mettent l'eau en communication avec la
surface. Ces cratères constituent souvent des lieux où
les hommes déversent leurs déchets. Ce type d'eau est
donc très mauvais bactériologiquement parlant, et
constitue très souvent un vecteur d'épidémies
privilégié.
Notes :
Lorsque les carbonates
(stalactites,coraux, coquilles
de molusques, calcites déposée sur les parois d'une
grotte) se forment dans l'eau, ils
fixent notamment l'uranium 238 que celle-ci contient. par ailleurs,
cet uranium se désintègre pour former du thorium 230.
En mesurant la quantité d'uranium 238 et de thorium 230
dans les carbonates, les chercheurs peuvent donc en connaître
l'age (datation d'une
centaine d'années à - 350 000
ans).
Autre méthode de datation des carbonates, la RPE
(résonance
paramagnétique
électronique) : les
minéraux stockent dans les défauts de leur
réseau cristallin, l'énergie émise par la
radioactivité naturelle . Cette dernière peut ensuite
être libérée si l'on expose, en laboratoire, le
matériau à un champ magnétique intense. La
quantité d'énergie alors émise renseigne sur
l'age de formation de ce minéral
(de -10 000 ans à - 1
millions d'années).
(n'en plaise à certains
créationnistes "Jeune-Terre", qui croient que la Terre
à environ 6000 ans...dont qqs% en France !).
En dépit de la variété de
leur composition, les eaux souterraines peuvent très
généralement être classées en :

Nota : la seule source ancienne à Paris encore en service,
est celle de la fontaine du square Lamartine à Passy, dans
le XVIème (de l'ingénieur
Charles G.Kind, et vidéo),
eau à forte teneur en sulfate de calcium et de fer.
 Aperçu sur les eaux
dites
minérales.
Aperçu sur les eaux
dites
minérales.
Les eaux minérales sont consommées en telle
quantité, en France, qu'il semble utile d'en dire quelques
mots.
Il faut voir dans cet engouement pour les eaux embouteillées
le reflet d'une certaine méfiance à l'égard des
eaux de distribution publique : à tord dans 90% des cas !.
(les eaux minérales se distinguent des eaux de source par leur
minéralisation supérieure !)
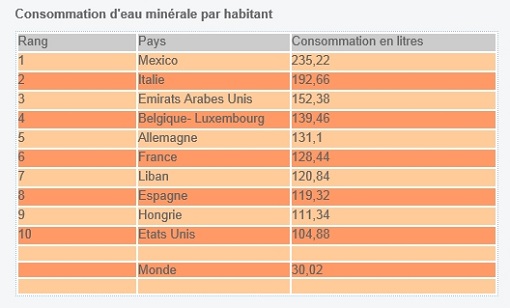
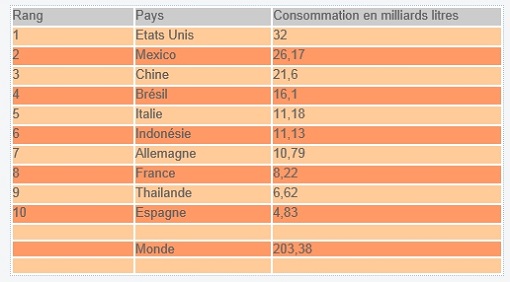
Ainsi chaque français consommerait, en moyenne, 145
litres d'eau minérale en bouteille par an
(chiffres 2018/2019).
Ils se situaient ainsi en 2011, derrière les Allemands, les
Belges et surtout les Italiens (192 L/an/hab),
les Européens les plus gourmands en bouteilles d'eau.
Cette consommation se répartirait comme suit :
La France serait aussi le premier producteur mondial d’eau en bouteille.
Le consommateur ignore souvent la composition
de ces eaux qui, bien souvent, sont médicinales et non
potables chimiquement, aux termes de la législation des
eaux de distribution. En effet, à
l'exception de deux ou trois, ces eaux sont trop (ou trop peu )
minéralisées. La plupart sont cependant très
riche en substances minérales.
Certaines émergent chaudes au griffon des sources, elles sont
alors dites thermales (82°C
à Chaudes Aiguës, 62°C La Bourboule, 45°C Le
Mont-Dore).
On les classe en différents groupes selon la nature du sel
prédominant.
Hypothèse - il est supposé par certains auteurs que les eaux minérales se soient formées par synthèse (?..) et non à partir des eaux d'infiltration : l'hydrogène qui se dégage des parties profondes du globe se combinerait à l'oxygène des oxydes métalliques du sol; et la vapeur d'eau ainsi produite pouvant ensuite réagir sur les sulfures donnant H2S, les chlorures donnant de l'acide chlorhydrique HCl. Ces acides se neutralisent ensuite au contact des roches (A. GAUTIER).
Signalons que,
réglementairement, les eaux minérales doivent
être bactériologiquement pures pour être
agréées.
Il est toutefois permis de les stériliser à l'ozone
et de les regazéïfier, à condition d'utiliser le
gaz des sources et non du gaz industriel.
Un mot pour terminer sur les eaux dites "de table".
Il s'agit d'eaux livrées en bouteille ne présentant pas
le caractère d'eau minérale. Il s'agit très
souvent de puits ou de sources exploitées par des
industriels.
Ces eaux peuvent subir n'importe quel traitement destiné
à les rendre potables de la même façon que les
eaux destinées à une adduction publique.
C'est ainsi qu'elles sont presque toujours stérilisées,
souvent filtrées et subissent même parfois un traitement
complet.
Les normes de potabilité concernant ces eaux ne
diffèrent de celles destinées à une distribution
publique que par une tolérance un peu moins grande en ce qui
concerne la turbidité et les teneurs en fer et en
manganèse.
Eau minérale = eau en bouteille ?
Non pas forcément, puisque toutes les eaux vendues en
bouteille ne sont pas minéralisées.
Certaines eaux comme la Cristaline ne sont pas des eaux
minérales. En ce qui concerne l’eau du robinet, selon les
régions, les eaux de ville sont plus ou moins naturellement
minéralisées. L’eau en bouteille n’est pas
toujours meilleure que celle du robinet qui contient souvent autant
de minéraux (calcium en particulier).
DÉFINITION DES EAUX MINÉRALES GAZEUSES.
"Les eaux minérales naturelles effervescentes
dégagent, à l'origine ou après embouteillage,
spontanément et de façon nettement perceptible, du gaz
carbonique dans les conditions normales de température et de
pression". (DIRECTIVE CEE N° 80/777 DU 15
JUILLET 1980 - ANNEXE 1).
Cette même directive limite l'usage de la mention
"acidulée" aux eaux contenant plus de 250 mg/l de CO2
libre.
Dans la norme ALINORM 97/20 adoptée par le Codex Alimentarius
lors de sa 22ème session à Genève du 23 au 28
juin 1997, on trouve la définition suivante :
Une "eau minérale naturelle naturellement gazeuse" est une eau
minérale naturelle dont la teneur en gaz carbonique est,
après traitement éventuel conformément à
la section 3.1.1, réincorporation éventuelle du gaz et
conditionnement, compte-tenu des tolérances techniques
usuelles, la même qu'à l'émergence. Il s'agit du
gaz carbonique spontanément et visiblement
dégagé dans des conditions normales de
température et de pression.
Ex : eaux gazeuses "naturelles" St-Yorre, Vichy Célestins,
Perrier ou Quezac; eaux "gazéifiées" ou
"pétillantes" (Badoit, Salvetat).
A contrario : Une "eau minérale naturelle non gazeuse" est une
eau minérale naturelle qui, à l'état naturel et
après traitement éventuel et conditionnement,
compte-tenu des tolérances techniques usuelles, ne contient
pas de gaz carbonique libre en proportion supérieure à
la quantité nécessaire pour maintenir dissous les sels
hydrogéno-carbonatés présents dans l'eau.
Ces remarques illustrent l'embarras du
législateur; reflet des problèmes particuliers
posés par les eaux gazeuses...
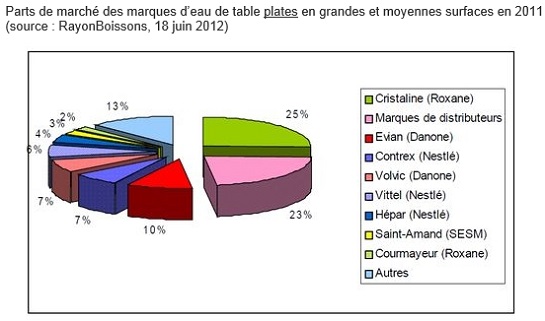
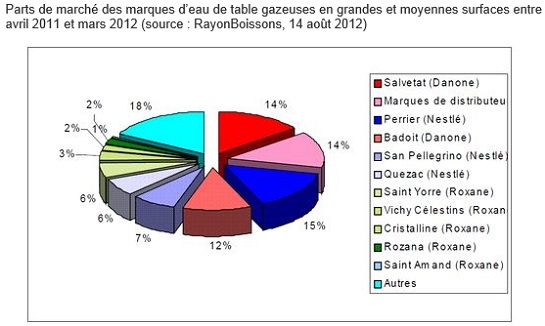
Le marché des eaux de table est très
concentré (83%).
Trois opérateurs dominent : Nestlé, Danone et le Groupe
Alma-Neptune (N°1 en France grâce à
Cristaline).
Dans les eaux gazeuses (27,6 % du chiffre d’affaires de la catégorie), c’est en revanche Nestlé Waters qui mène la danse en part de marché (40,4 %), loin devant Danone Eaux (28,2 %) et Neptune (11,7 %).
Abatilles, Aix-les-Bains, Alet, Arcens, Arvie, Asperjoc,
Badoit,
Celtic, Cilaos, Contrex, Drômeline, Évian, Hépar,
Jouvence,
Mont-Roucous, Ogeu, Orezza, Parot, Perrier, Plancoët,
Quézac, Rozana, Saint-Alban, Saint-Amand-les-Eaux,
Saint-Georges, Saint-Géron, Sainte Marguerite,
Saint-Yorre,La Salvetat,
Teissières-lès-Bouliès,
Thonon, Treignac, Vals, Vernière,
Vichy, Vittel, Volvic.
-------
(L'eau minérale "de Velleminfroy", déclarée
« eau minérale naturelle » par décret de
l’Académie impériale de médecine en 1859,
est exploitée à nouveau depuis 2016)
-------
Composition
moyenne de quelques eaux françaises du commerce :
|
|
|
|
|
|
|
|
Résidu sec ( à 180°C) |
1200 |
2125 |
400 |
2580 |
476 |
|
pH |
6,0 |
7,1 |
7,3 |
7,0 |
5,1 |
|
Cations : |
|||||
|
Calcium |
190 |
486 |
79 |
555 |
142 |
|
Magnésium |
85 |
84 |
25 |
110 |
3,7 |
|
Sodium |
150 |
9,1 |
5,8 |
14 |
15 |
|
Potassium |
10 |
3,2 |
1 |
3,8 |
0,66 |
|
Manganèse |
1 |
0,008 |
0,001 |
0,0004 |
0,002 |
|
Anions : |
|||||
|
Hydrogènocarbonates |
1300 |
403 |
351 |
403 |
326 |
|
Sulfates |
40 |
1187 |
10,4 |
1479 |
76 |
|
Chlorures |
40 |
8,6 |
2,7 |
10,5 |
30,5 |
|
Nitrates |
21 |
2,7 |
3,5 |
3,9 |
27 |
|
Fluor |
1 |
0,36 |
0,08 |
0,38 |
0,1 |
|
|
|
|
|
|
|
|
|
|
Résidu sec (180°C) |
~1930 |
105 |
139 |
3300 |
200 |
201 |
3022 |
|
pH |
|
7,1 |
8,0 |
6,3 |
7,6 |
|
6,3 |
|
Cations : |
|||||||
|
Calcium |
241 |
9,3 |
41 |
103 |
63 |
67,6 |
301 |
|
Magnésium |
95 |
5,9 |
3 |
11,4 |
10,2 |
2 |
160 |
|
Sodium |
255 |
8,6 |
2 |
1240 |
1,4 |
1,9 |
493 |
|
Potassium |
49,7 |
5 |
0 |
70,8 |
0,4 |
0,2 |
52 |
|
Manganèse |
|
0,002 |
|
0,002 |
|
|
|
|
Anions : |
|||||||
|
Hydrogènocarbonates |
1685,4 |
58 |
134 |
3111 |
173,2 |
204 |
1837 |
|
Sulfates |
143 |
6,6 |
2 |
173 |
51,3 |
18 |
230 |
|
Chlorures |
38 |
5,5 |
3 |
240 |
240 |
4 |
649 |
|
Nitrates |
<1 |
4,9 |
3 |
3,6 |
<1 |
3,5 |
1 |
|
Fluor |
2,1 |
0,24 |
|
5,6 |
|
|
|
La marque « Cristaline » est la propriété
du Groupe Alma,
et a pour filiales Neptune et la
Compagnie Générale des Eaux de Source
(CGES), et pour marques Saint-Yorre,
Vichy Célestins, Thonon, Pierval,
Chateldon, Courmayeur et Cristaline,
Vernière et Rozana, et des marques
régionales.
Cristaline détient 16.3 % de parts de marché en tant
que leader.
>site officiel : https://www.moneaucristaline.fr/
S'il y a des données communes à toutes les eaux
(selon le site officiel, toutes les sources
comportent des teneurs inférieures à 8 mg/l en nitrates
et 180 mg/l en calcium), il y a aussi des variations dans la
composition.
Exemple, Eaux de source produites à Cairanne :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
à 180 °C |
|
|
|
|
|
|
|
|
|
(étiquette 2010) |
Nota : issues d'écosystèmes
préservés, les eaux minérales naturelles et les
eaux de sources répondent à un strict cahier des
charges, gage de leurs qualités.
Dépendantes de la nature des sols dans lesquels elles ont
voyagé, ces eaux sont en constantes interactions avec
l'écosystème dont elles dépendent.
Aujourd'hui fragilisés par les changements climatiques et la
surexploitation, ces écosystèmes fragiles sont
menacés.
-------------------------------------------------------------------------------------------------------------------------------------------------
> Voir la carte des eaux
françaises (origine Aquamania.net)
>> télécharger la
carte (Carteeauxfrance.zip, 53 ko)
>>>
Liens Législation
(Aquamania.net).
QUE D'EAU !
(collection d'étiquettes de bouteilles d'eau)

L'eau étant un excellent solvant, les eaux naturelles
ne sont jamais pures (espèce chimique H2O seule) mais une
solution plus ou moins diluée d'un grand nombre de
substances.
Des substances qui peuvent avoir une origine naturelle ou une
origine étrangère (exogène).
SUBSTANCES
D'ORIGINE NATURELLE
Les gaz
Tous les gaz de l'air sont présents dans les eaux
naturelles.
Leur solubilité est régie par les lois de Henry
et de Dalton : voir, éventuellement, les notes sur la
loi de Henry ou les lois
générales des gaz (pages
internes).
 On rencontre donc toujours dans les eaux naturelles
:
On rencontre donc toujours dans les eaux naturelles
:
- Du dioxyde de
carbone (CO2) ou anhydride carbonique
(gaz carbonique, lien
page interne).
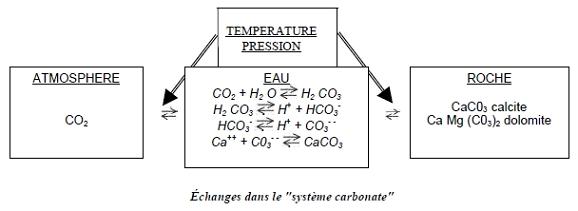
Notes sur l'origine du gaz.
On mentionnera l'existence de CO2 d'origine profonde, produit par
métamorphisme des formations carbonatées, notamment
à la périphérie des provinces volcaniques; le
dégagement de CO2 serait produit par des réactions de
type :
Ces dégagements de gaz peuvent soit remonter directement
jusqu'en surface sans relais ni stockage intermédiaire, soit
être piégés dans des systèmes
intermédiaires (couches de charbon) ou
des aquifères captifs de nature calcaire.
Egalement, encore la remontée actuelle de CO2
d'origine magmatique, formant par exemple la province des eaux
bicarbonatées sodiques du Massif Central.
Enfin, le CO2 peut être d'origine
biogénique : dans les horizons
superficiels, l'activité biologique de la faune et de la flore
peut contribuer localement à la création de pressions
partielles de CO2 dans les sols excédant nettement la pression
de CO2 atmosphérique (environ
3,89.10-4 atm ou 0,394 hPa).
Solubilité du gaz dans l'eau pure
(à TPN >1013 hPa et 0
°C) : 1,7 vol/vol.
Nota - l'équilibre :
est réglé par la constante de Henry dont la valeur est (1013 hPa et 25 °C) :
avec
pCO2 : pression
partielle de CO2 et
[H2CO3]
: activité.
- Cette constante varie avec la température suivant
l'expression empirique :
avec t, température en ° Celsius.
- Notons que l'activité
[H2CO3] représente la
molécule H2CO3 vraie (acide carbonique)
et le CO2 dissous moléculaire présent à
l'état de microbulles.
Par conséquent par exemple, dans une eau de surface à
25°C, on aura :
soit environ 0,53 g de CO2 libre par kg
d'eau pure, ou 0,53 mg/litre.
La limite de solubilité de ce gaz en équilibre avec
l'atmosphère est donc en fait assez basse (moyenne) :
cependant, la solubilité physique du CO2 constatée est, elle, très élevée , et nettement plus élevée que les autres gaz atmosphériques (N2 et O2), et les quantités retrouvées dans les eaux naturelles sont presque toujours très supérieures aux valeurs ci-dessus en raison des facteurs suivants :
Également, ci-dessous la quantité maximum de CO2 dissous dans l'eau pure (en mg/l), sous pression de CO2 et pression atmosphérique :
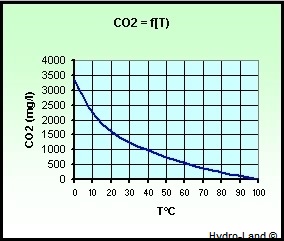
Le CO2 se dissout donc dans l'eau en se combinant partiellement :
pour former de l'acide carbonique (H2CO3) en
partie dissocié en ions : >>>
HCO3- + H+ (ion
hydrogénocarbonate et ion
hydrogène),
et
Ce phénomène est essentiel et influence dans
une large mesure le pH des eaux des mers et du sol, et constitue l'un
des facteurs du comportement acide de ces eaux vis-à-vis du
carbonate de calcium (ceci est précisé
dans l'étude des équilibres
calco-carboniques).
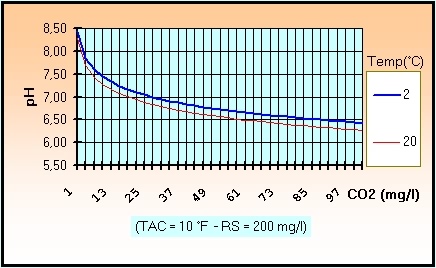
Ci-joint, par exemple, la variation du pH (
concentration en [H+] ) en fonction du CO2,
dans une eau avec un TAC de 10°F et une minéralisation
totale (un résidu sec) de 200 mg/l, ceci pour deux
températures :
- de l'oxygène
(dioxygène ou O2, lien
interne sur ce gaz).
Ce gaz n'est pas dissocié. Il n'a aucune action directe sur la
santé.
Cependant, l'oxygène dissous constitue pour les eaux de
surface un indicateur de qualité car la diminution de la
teneur en O2 est quasi généralement le fait
d'une activité biologique. La teneur en oxygène dissous
revêt également une certaine importance dans les
phénomènes de corrosion.
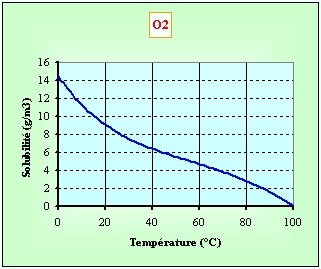
Ci-joint :
Quantité d'O2 dissous au maximum
(solubilité, en g/m3 ou
mg/l) dans l'eau pure :
0-40.jpg)
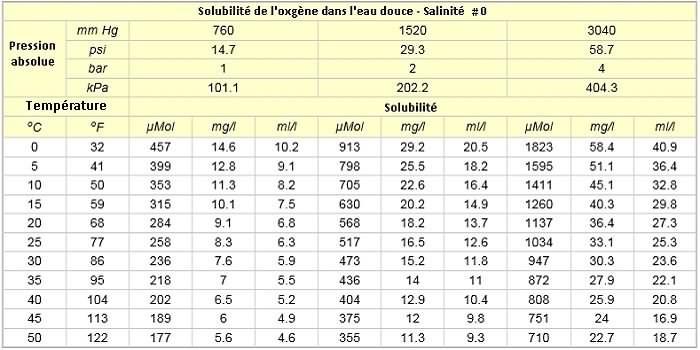
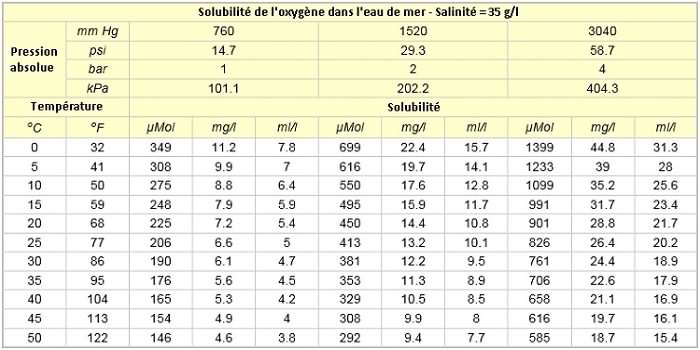
Variation de la saturation en oxygène en fonction de la
pression et de la salinité de l'eau (mg/l) :
Rappel : 1 atmosphère dite "normale"
- lien
interne - (ou pression atmosphérique standard
) = 101 325 Pa
[newton / m²]
ou 1 013,25 hPa, donc 1 013 250 dynes par
centimètre carré (dyn/cm²), ou 1033,227 cm H2O
à 4 °C (kg-force/cm², ou atmosphère
technique) ou 760 mm Hg.
< Résolution 4 de la
10ème CGPM (1954, CR,79)
>
Nota : la quantité d'oxygène
dissous, est donc fonction de la température et de la
salinité, et une bonne idée des teneurs en
O2 dissous est donnée par la
formule de Gameson
avec T=température en °C.
Formule de Gameson et Robertson pour eau
salée (1<S<50
g/l) :
avec, S=salinité en g/l et T=température en
°C.
Nota :
> http://onlinelibrary.wiley.com/doi/10.1002/jctb.5010050909/citedby/
On peut aussi appliquer avec suffisamment de précision ce
polynôme du second degré (valable entre 0 et 30°C)
:
avec Cs concentration en O2 dissous à saturation
sous la pression atmosphérique (en mg·L- 1) et
t température (en °C).
Par ailleurs, une excellente approximation peut également
être obtenue à partir de la formule de
Mortimer (1981) qui présente
l’avantage de s’appliquer entre 0 et 50°C :
Téléchargement
d'une feuille de tableur pour calculs de la teneur en
oxygène
> ici
-------------------------------------------------------------------------------------------------------------------------
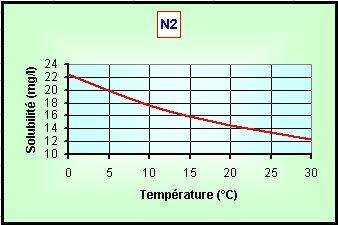
- de l'azote (diazote,
N2).
Non dissocié, ce gaz inerte n'a aucune conséquence sur
la qualité de l'eau.
Quantité d'azote dissous au maximum (solubilité,
mg/l ou g/m3) dans l'eau pure :
On peut encore trouver, souvent à l'état de traces, un
certain nombre de gaz dissous dans les eaux profondes.
Ce sont principalement
Les sels.
Sels formés à partir de bases fortes et d'acides
forts :
Les plus importants sont les chlorures, les sulfates et
les nitrates. Ils sont totalement dissociés (sous forme
d'ions négatifs ou anions) et on les trouve conjointement avec
leurs cations (ions positifs) qui peuvent être :
Ca++, Mg++, Na+, K+ ,
etc.
<Nota : liens sur les chlorures (halogénures),
les sulfates
et les nitrates
naturels >
(Webmineral,
du BRGM).
Sels de bases fortes et d'acides faibles :
Ces sels ne sont que partiellement dissociés. Le seul acide
faible rencontré dans les eaux (à l'exception de H2S
éventuellement présent à l'état de
traces) est l'acide carbonique déjà cité.
Les sels les plus abondants sont ceux de calcium et, dans une moindre
mesure, le magnésium. Parmi ceux-ci :
Les autres cations (Na, K) donnent des sels semblables, mais dont la solubilité est très supérieure.
Les matières en
suspension.
Le ruissellement des eaux de surface entraîne toujours une
quantité plus ou moins importante d'éléments
minéraux insolubles, de taille très variable. Ces
substances constituent les matières en suspension.
Une partie de ces particules ont une taille suffisamment importante
pour décanter spontanément dès que le
régime hydraulique s'y prête. Il s'agit de
suspensoïdes constitués le plus souvent de sables et
d'argiles.
Une autre partie est constituée de particules très
fines (colloïdes), très lentement
décantables ou non décantables car affectées par
le mouvement brownien.
Cette dernière part est responsable de la
turbidité.
Le traitement d'une eau visant en premier lieu sa clarification
(action de clarifier : rendre clair un liquide trouble) :
Toutes les particules ne troublent pas l'eau de la même
façon. Les particules très fines et les colloïdes.
diffusent la lumière, mais ne se voient pas à l'oeil nu
(en particulier, les bactéries peuvent
être en nombre considérable sans causer le moindre
louche), tandis que les particules plus grosses absorbent la
lumière sans la diffuser.
Ce ne sont que les particules dont le diamètre est du
même ordre de grandeur de la lumière blanche, soit 0,4
à 0,8 micron qui absorbent la lumière tout en la
diffusant.
Toute tentative d'évaluation des teneurs en matières
en suspension à partir d'une mesure de turbidité n'est
pas parfaite puisque la nature et la taille des particules varieront
et dans l'espace et dans le temps. On trouve dans la
littérature, des formules reliant turbidité et MES.
Elles sont à considérer avec la plus grande
circonspection. Notre expérience permet d'affirmer que dans la
quasi totalité des cas, aucune corrélation directe
(sans mesure de contrôle) ne peut être trouvée
entre ces deux paramètres.
Toutefois, en première approximation on peut
corréler la turbidité (NFU)
à la concentration MES :
NB : 1 NFU = 1 NTU (voir plus loin).
Outre leur aspect peu engageant et
psychologiquement négatif, les eaux troubles présentent
le grave inconvénient de provoquer des dépôts
dans les réseaux, réservoirs et organes de
distribution.
En ce qui concerne la santé, les particules terreuses ne sont
pas nocives en elles-mêmes. Elles constituent cependant un
excellent support pour les bactéries qu'elles protègent
de l'action des désinfectants.
Une désinfection efficace a donc toujours pour première
condition une excellente clarification.
une turbidité de 2 NFU est donnée
comme indicateur témoin.
Actuellement : Décret
n°2001-1220 du 20 décembre 2001 relatif aux eaux
destinées à la consommation humaine, à
l'exclusion des eaux minérales naturelles.
NB : en cas de mise en œuvre d'un traitement de
neutralisation ou de reminéralisation, la
référence de qualité s'applique hors
augmentation éventuelle de turbidité due au
traitement.
Rappel : 1 NFU (Nephelometric
Formazine Unit) = 1 NTU (Nephélometric
Turbidity Unit),
et, 1 NFU = 1 FTU (Formazine Turbidity Unit) = 1 FNU (Formazine
Nephélometric Units).
NOTA :
En océanographie, on utilise depuis longtemps pour
mesurer la turbidité de l'eau de mer, le disque de
Secchi*: il s'agit d'un
disque horizontal de dimension normalisée (20
ou 30 cm) descendu dans l'eau à l'aide d'une ligne
graduée qui permet de mesurer la transparence d'une
étendue d'eau, celle-ci sera d’autant plus
élevée que la turbidité sera faible, ou plus la
valeur du Secchi est importante, plus la turbidité sera faible
:
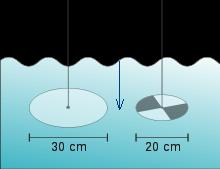
Méthode : on mesure la profondeur à laquelle le
disque disparaît pour l'observateur situé à la
surface, ou la profondeur à laquelle il
réapparaît. La "profondeur de Secchi" exprimé en
mètre (Secchi depth ou SD en anglais)
obtenue par moyenne de ces mesures constitue une approche de la
mesure de turbidité.
*Le disque Secchi a
été nommé d'après son inventeur Pietro
Angelo Secchi (1818-1878),
astronome italien (et jésuite) qui fut directeur de
l'Observatoire du Vatican. Le disque servit pour la première
fois en mer Méditerranée en 1865. Il a les avantages
d'être léger, peu encombrant, bon marché et
simple d'utilisation.
Par ailleurs, la couleur elle-même varie
avec l'origine des eaux et les saisons. Les teintes
s'échelonnent entre le bleu et le brun, en passant par le vert
et le vert-jaune. Certains micro-organismes peuvent communiquer
à l'eau une apparence tout à fait inhabituelle, telle,
par exemple l'algue trychodesnion erythroteum qui est rouge sang
(sang des bourguignons, mer rouge, lacs Australiens).
Pour caractériser au mieux la couleur, aucune méthode
ne donne pleinement satisfaction. En pratique, on se contente de
comparer la couleur de l'eau à celle d'une solution
standard constituée par un mélange de sels de
platine et de cobalt.
L'unité de couleur est le mg/l Pt/Co, appelé
encore souvent degré Hazen.
La teinte de la solution étalon présente une coloration
jaune verdâtre qui s'apparente assez bien à celle de la
plupart des eaux naturelles. Toutefois, elle s'éloigne
largement de la couleur observée pour les eaux riches en
substances humiques (à base d'humus : lacs, barrages) qui est
plutôt brune. La mesure de la couleur est donc entachée
d'une très grande imprécision, d'autant que son
appréciation varie beaucoup d'un individu à un
autre.
Les matières
organiques.
Les substances organiques naturelles trouvées dans l'eau
proviennent de la dégradation par voie biologique des
végétaux et des animaux. Ces substances sont de natures
très diverses et il est extrêmement difficile, sinon
impossible, d'en distinguer la nature et/ou l'origine.
La présence d'une quantité importante de
matières organiques dans une eau la rend suspecte non pas
à cause de la nocivité intrinsèque des
substances dissoutes, mais parce que l'on redoute que cette abondance
ne constitue l'indicateur d'une mauvaise protection de la
ressource.
L'abondance de matières organiques peut entraîner
l'apparition de goûts et odeurs désagréables et
très souvent une forte coloration (cas de substances dites
"acides humiques" et "acides fulviques").
Les matières organiques constituent une source
privilégiée de carbone organique favorisant la
croissance des bactéries, des algues, du zoo plancton qui
consomment de l'oxygène dissous.
L'évaluation des concentrations en substances organiques
relève toujours d'une mesure globale qui ne donne aucune
indication sur la nature des composés rencontrés.
Les normes prennent en compte :
La concentration en matières organiques s'exprime alors en
mg/l O2 consommés.
La méthode normalisée en France réalise un test
d'oxydation au permanganate en 10 minutes à 100
°C en milieu acide.
Dans ces conditions, la valeur limite pour les eaux potables a
été fixée à 5 mg/ O2.
Cette valeur est assez élevée et peut être
incompatible avec le critère couleur. Il faut s'efforcer, mais
c'est là une opération difficile, de ramener la valeur
de l'oxydabilité au voisinage du niveau guide des normes
européennes, soit 2 mg/l O2.
SUBSTANCES D'ORIGINE
ÉTRANGÈRE.
Il s'agit des substances de toute nature provenant des
animaux, de l'homme, ou résultant des activités de
l'homme.
Les eaux de surface et , dans une moindre mesure, les eaux
souterraines peu profondes constituent le réceptacle ultime et
naturel de tous les déchets.
Il s'agit de la pollution qui est d'ailleurs un
phénomène inéluctable et en quelque sorte
naturel. Pendant fort longtemps, cette pollution était
parfaitement équilibrée par les processus
d'auto-épurations du milieu. Elle n'avait donc pas de
conséquences négatives.
L'accroissement démographique, l'industrialisation des
productions agricoles et manufacturées,
l'élévation du niveau de vie ont rompu ce fragile
équilibre.
On trouve donc désormais dans les eaux un grand nombre de
substances indésirables, dont l'origine peut être :
Les concentrations de ces substances sont,
fort heureusement, très faibles et l'on parle de
micro-pollution minérale ou organique.
Il faut ajouter à ces substances celles qui sont introduites
volontairement dans l'eau pour réaliser sa potabilisation.
Il s'agit de sels minéraux (de fer ou d'aluminium pour les
floculants), du chlore utilisé pour la désinfection ou
des composés formés par action de ces corps sur des
ions ou des molécules initialement présents dans l'eau
(chloramines, organo-chlorés, par exemple).
|
|