GENERALITES :
Le dioxyde de carbone est le résultat de la
combinaison de deux éléments : un atome de carbone
C et deux atomes d'oxygène O, soit
CO2 (ou O=C=O).
Masse molaire 44,0098 g mol-1.
Il est produit par différents processus : notamment lors de la
fermentation aérobie ou de la combustion de composés
organiques, et lors de la respiration des êtres vivants et des
végétaux. Pour ces derniers, la photosynthèse
piège beaucoup plus de CO2 que sa respiration n'en
produit.
On le trouve en faible proportion dans l'air
atmosphèrique ou il est assimilé par les plantes qui,
à leur tour, produisent de l'oxygène.
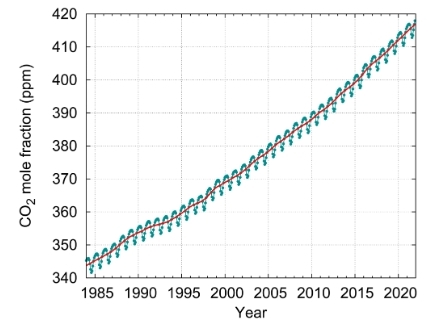
En septembre 2021, il y est présent à 413,30 ppmv
(parties par million en volume) -
(Données du
NOAA*
et du Mauna Loa Observatory-MLO).
*(NOAA
: National Oceanic and Atmospheric Administration, USA)
Augmentation globale d'environ 42 % en 177 ans.
Mais elle augmente rapidement, d'environ 1,43 ppmv/an, de par les
activités humaines de consommation des combustibles fossiles :
charbon, pétrole, gaz.
Selon la NOAA par ailleurs, le taux de concentration moyen de
dioxyde de carbone dans l’atmosphère aurait donc atteint
en septembre 2022, 415,95 parties par million et par volume
(415,95
ppmv), soit la teneur la
plus élevée jamais mesurée.
 ...
...
(moyennes mensuelles du CO2
dans la décénnie 2015-2022 et
mesure globales du CO2 de 1980 à 2022 -
source
NOAA)
Les abondances moyennes mondiales des gaz à effet de serre
majeurs (bien mélangés et à vie longue) -
dioxyde de carbone, méthane, protoxyde d'azote, CFC-12 et
CFC-11 -
du réseau mondial d'échantillonnage de l'air NOAA sont
relevées depuis le début de les gaz représentent
environ 96% du forçage radiatif direct par les gaz à
effet de serre à vie longue depuis 1750.
Source > World Meteorological Organization
(WMO) - 24 nov 2021
----------------------------------------------------------
Nota : les proportions massiques peuvent être
évaluées approximativement en multipliant les
proportions volumiques par le rapport de la masse molaire du gaz
considéré, divisé par la masse molaire
théorique de l'air soit 28,95 g environ, par
exemple dans le cas du CO2 ce rapport n' est pas
négligeable puisqu'il vaut (12,011/28,95) =
0,41488, d'ou la teneur massique en CO2 dans
l'air en septembre 2022, égale à
(415,95 x 0,41488) = 172,57 ppm en masse.
----------------------------------------------------------
Rappel : c'est la photosynthèse qui maintient constant
le taux d'oxygène O2 dans l'atmosphère
terrestre et fournit toute la matière organique ainsi que
l'essentiel de l'énergie utilisées par la vie sur
Terre. Ce processus bioénergétique permet aux plantes,
aux algues et à certaines bactéries, dites
photoautotrophes, de synthétiser de la matière
organique en utilisant la lumière du soleil. Des glucides, par
exemple des oses tels que le glucose, sont synthétisés
à partir du CO2 et de l'eau H2O avec
libération d'oxygène O2 comme sous-produit
de l'oxydation de l'eau.
NB. Le nombre de milliards de tonnes (Mdt) de
CO2 relâchées dans
l'atmosphère (en 2018), s'élève à 36 831
Mdt (36, 831 Tt).
Les "plus mauvais élèves" sont la Chine et les
États-Unis avec 27 % et 15 % des émissions
respectivement (9% pour l'Union Européenne).
Ce classement est valable pour le total des émissions, mais
les États-Unis, la Russie, l'Arabie saoudite et le Canada -
lorsque l'on ramène cela par habitant - sont tous les quatre
en tête du classement.
------------------------------------------------------------------------------------
Effets écosystémiques de l'augmentation du taux de
CO2 dans l'eau :
Le CO2 a un certain effet eutrophisant (c'est un
nutriment de base, essentiel pour les plantes), mais il est
aussi un facteur d'acidification des
océans et de certaines masses d'eau douce, qui peut
négativement interférer avec de nombreuses
espèces (dont certaines microalgues et autres
microorganismes aquatiques protégées par des structures
calcaires que l'acide carbonique peut dissoudre). Effet
important avant la fin du XXIe siècle...car le pH baisse et
risque d'atteindre 7,8 (actuellement pH = 8)
!
L'acidification favorise aussi la libération et la circulation
et donc la biodisponibiltié de la plupart des métaux
lourds, métalloïdes ou
radionucléides (naturellement présent
dans les sédiments ou d'origine anthropique depuis la
révolution industrielle surtout).
VALEURS DE LA PRESSION PARTIELLE DE CO2 :
Dans l'atmosphère, elle était à la fin des
années 1970 de 2.10-4 atm (0,203 hPa ), vingt ans
plus tard, du fait de l'évolution des activités
humaines elle est en moyenne en 1990 de 3,4.10-4 atm
(0,344 hPa), et en 2018 de 3,89.10-4 atm (0,394 hPa), soit
une augmentation de 48,5 % en presque 50 ans (presque 1% par an).
Nota : 1 atm =
1013,25 hPa
---------------------------
C'est un gaz à effet de serre
(GES, voir ici)
dont la contribution relative à ce phénomène
serait de 49 % (le
méthane CH4 de 18 %).

(source : Sciences et Avenir, 04/2012)
Propriétés.
Le CO2 gazeux a une odeur très
légèrement irritante, il est incolore et plus lourd que
l'air (Masse Volumique : 1,87 kg
m3-1
à 15°C).
En solution aqueuse, il forme l'acide carbonique
H2CO3 ( H2O +
CO2 <==> H2CO3
) qui est trop instable pour pouvoir être isolé
facilement.
Graphique de Pression de vapeur en fonction de la
température :

------------------------------
Le diagramme des phases du dioxyde de carbone
(CO2,
anhydride ou gaz carbonique) ci-dessous, montre que,
contrairement à l'eau, la courbe solide (glace
carbonique) et liquide
(CO2
liquide) présente une pente positive : la glace de
CO2 est plus dense que le gaz
liquéfié.
Nota : Masse volumique de la phase liquide
(à -20 °C et 19,7
bar) : 1032 kg/m3 et Masse volumique du solide
: 1562 kg/m3.
Seul gaz présent sous quatre formes : solide, liquide,
gazeuse et supercritique.

(rappel : 1 bar = 1000 hPa = 0,1 MPa)
La phase liquide ne peut exister qu'à une pression
minimale de 519 kPa (5,19 bar ou 5,122 atm), et dans un intervalle de
température allant de -56,6 °C (216,6 K,
point triple) à 31,1 °C au maximum
(304,3 K) à 7,38 MPa
(73,8 bar ou 72,83 atm) -
(point critique).
Par ailleurs, le Point triple (
Température = -56,6 °C (216,6
K) et Pression : 5180 hPa [5,18 bar ou
5,112 atm] ) est supérieur à la pression
atmosphérique "normale" de 1013,25 hPa (1,013
bar), ainsi donc le CO2 liquide
ne peut exister à cette pression (il ne peut
donc fondre, ni bouillir à cette pression), par contre
il peut se sublimer a toutes pressions inférieures.
Le Point Critique se situe donc à Pc = 7,38 MPa
(73,8 bar ou 72,83 atm) et Tc = 31,3
°C (304,5 K) .
Le CO2 solide est
appelé glace sèche (car
elle ne fond pas, elle se sublime). Nota > aussi
appelé : « glace carbonique », « neige
carbonique », ou « Carboglace™ ».
A noter qu'à 1 atm (1013 hPa ou 1,013
bar), la température de sublimation de cette glace
sèche est de -78,48 °C (194,67 K).
L'enthalpie de sublimation est de 573 kJ·kg-1 (soit
25,2 kJ·mol-1),
Le CO2 se transporte habituellement à
l'état liquide dans des cylindres d'acier sous pression
(- 20°C et 20 bar).
Solubilité du gaz dans l'eau
(à TPN >1013 hPa et 0 °C) : 1,7
vol/vol, et, 3350 mg/kg à 0 °C, 973 mg/kg à 40
°C et 576 mg/kg à 60 °C.
Solubilité du CO2 en mg par litre dans l'eau pure
(pression atm. et sous pp du gaz) en fonction
de la température :

Nota - l'équilibre :
CO2 gaz + H2O
<<>>
H2CO3
est réglé par la constante de Henry dont la valeur
est (1013 hPa et 25 °C) :
KH = (
[H2CO3]
/ pCO2 ) =
10-1,46
avec
pCO2 : pression
partielle de CO2 et
[H2CO3]
: activité.
- Cette constante varie avec la température suivant
l'expression empirique :
log KH = 1,46 + 0,0127 (t-25)
avec t, température en ° Celsius.
- Notons que l'activité [H2CO3] représente
la molécule H2CO3 vraie (acide
carbonique) et le CO2 dissous moléculaire
présent à l'état de microbulles.
------------------
Quelques caractéristiques :
- Inerte, incolore et ininflammable.
- Equivalent gaz/liquide (1013 hPa, et 15
°C [par kg de solide]) : 845 vol/vol
- Chaleur latente de vaporisation du CO2
liquide (1013 hPa, au point
d'ébullition) : 571,08 kJ
kg-1
- Pression de vapeur du CO2 liquide
(à 20 °C) : 5,85 MPa (58,5
bar).
- Point triple : Température = -56,6 °C et Pression
: 5180 hPa (5,18 bar)
- Chaleur latente de fusion de la glace
sèche (1013 hPa, au point triple) :
196,104 kJ kg-1
- Point critique : Température : 31 °C
(304 K) et Pression critique : 7,38 MPa
(73,8 bar)
Masse volumique au point critique
(liquide/gaz) : 464 kg
m3-1
- Masse volumique du gaz à 1013
hPa (1 atm) : 2,814 kg
m3-1 à -78°C et 1,87
kg m3-1 à 15°C
- Chaleur spécifique du gaz à pression constante
(Cp) (1013 hPa et 25 °C) : 37
J/(mole.K)
- Chaleur spécifique du gaz à volume constant (Cv)
(1013 hPa et 25 °C) : 28
J/(mole.K)
- Viscosité du gaz (1013 hPa et 0
°C) : 0,0001372 Poise
- Vitesse du son (0 °C,1 atm) : 259
m s-1
- Concentration moyenne du CO2
dans l'air (mi-2010) : 0,0389 % en volume
(ou 0,0585% en masse).
Normalisation.
Norme sur les produits utilisés pour la production
d’eau potable : bulletin
officiel - Dioxyde de carbone, Anhydride carbonique : NF EN
936.
Utilisations.
Généralités.
Le CO2 peut servir à beaucoup de choses dont la principale
est l'extinction des feux. Beaucoup de datacenters (salles de
serveurs d'ordinateurs) ou de salles des archives sont
équipées d'un système qui, en cas d'incendie,
remplit la salle de CO2 ce qui à comme
effet d'éteindre le feu.
Il est aussi utilisé en aquariophilie pour une meilleure
croissance des plantes.
Il permet de maîtriser le pH des effluents aqueux (excellente
alternative au contrôle du pH par l'acide sulfurique).
Il peut aussi être utilisé sous forme liquide,
comme :
- refrigérant pour congeler certains aliments,
- réfrigérant dans l'industrie
électronique,
- agent d'extinction dans les extincteurs dits « au dioxyde
de carbone », on parle parfois de neige carbonique parce que
le CO2 liquide se solidifie
immédiatement à la sortie de l'extincteur en
produisant une poudre blanche,
- agent propulseur (et parfois également carbonatant)
pour les boissons servies à la pression.,
et sous forme solide ou glace carbonique (appelée
aussi Carboglace ou glace sèche). Cette glace carbonique se
sublime en ne laissant aucun résidu et produit très
rapidement une grande quantité de froid (150 fr/h/kg à
-78,5 °C), l'homme lui a donc rapidement trouvé de
multiples utilisations :
- sous forme de "pellets" (taille d'env.
3 mm de diamètre) : essentiellement pour le
nettoyage et le décapage cryogénique,
- en "sticks" (bâtonnet de 16
mm) : pour la conservation, le transport des produits sous
température dirigée (produits
pharmaceutique, transport de surgelés, transport
d'échantillons etc.),
- pour la recherche fondamentale ou appliquée,
- pour la vinification : ralentit la fermentation et
évite l'oxydation,
- en "plaquette" ou en "blocs" :
- pour le ravitaillement aérien
(catering), les traiteurs, les pompes
funèbres etc.
- en "pains"
- pour faire de la fumée épaisse
(effets spéciaux, cinéma,
vidéo).
Comme l'eau, au delà de son point critique
(voir plus haut), le dioxyde de carbone entre
dans une phase appelée "supercritique".
La courbe d'équilibre liquide gaz est interrompue au niveau du
point critique, assurant à la phase supercritique un continuum
des propriétés physico-chimiques sans changement de
phase. C'est une phase aussi dense qu'un liquide mais assurant des
propriétés de transport (viscosité, diffusion)
proche d'un gaz. Le dioxyde de carbone supercritique est
utilisée comme solvant "vert", les extraits étant
exempt de trace de solvant :
- décaféination du café,
- traitement du goût du bouchon dans les bouchons de
liège,
- mise en forme de principes actifs micronisés et sous
forme nanométrique,
- extraction de composés chimiques ou biologiques,
- purification de composés chimiques
(phase mobile en chromatographie, notamment en
HPLC),
- pour le transport et le stockage lors de la
séquestration géologique du dioxyde de carbone
(rares applications industrielles),
- lors de la maniipulation d'organes artificiels, et en
mélange avec l'air ou l'oxygène pour doper la
respiration.
Il sert aussi pour la dilatation chirurgicale par insufflation
intra-abdominale.

Applications
industrielles.
Pâtes et papiers
Le dioxyde de carbone de réguler finement le pH des
pâtes recyclées, mécaniques ou chimiques
après un blanchiment alcalin. Il peut être
également utilisé dans la neutralisation du "tall oil"
et pour l'amélioration du fonctionnement des machines à
papier.
Industrie chimique
Le dioxyde de carbone est utilisé en chimie de
synthèse ou pour le contrôle de la température
des réacteurs. Le CO2 est également mis en œuvre
pour la neutralisation des effluents alcalins.
Il est utilisé sous des conditions supercritiques pour
réaliser des purifications ou des opérations de
teintures de fibres polymères ou végétales ou
animales.
Industrie pharmaceutique
Le dioxyde de carbone est utilisé pour l'inertage, la
synthèse chimique, l'extraction en phase supercritique (SFE),
la neutralisation (pH) des effluents aqueux ou le transport de
produits à basse température
(-78 °C or -108 °F).
Alimentaire et boissons
Le CO2 est utilisé dans le secteur alimentaire dans ces
principaux domaines :
- La carbonatation des boissons gazeuses, comme les sodas, l'eau
minérale ou la bière,
- Dans le conditionnement des denrées alimentaires, ses
propriétés d' inertage et bactériostatiques
se combinent bien avec celles de l'azote et augmentent la
durée de vie des aliments,
- Comme fluide cryogénique dans les opérations de
refroidissement ou de congélation ou comme glace carbonique
pour la régulation des températures pendant la
distribution des denrées alimentaires,
- La caféine est ôtée du café par du
CO2 supercritique.
Santé
Le CO2 produit une atmosphère proches des conditions
physiologiques lors de la manipulation d'organes artificiels.
Il est utilisé en mélange avec l'air ou
l'oxygène pour doper la respiration.
Il sert aussi pour la dilatation chirurgicale par insufflation
intra-abdominale.
Industrie des métaux
Le dioxyde de carbone est généralement utilisé
pour la protection de l'environnement :
- le CO2 est employé pour supprimer les fumées
rousses pendant le chargement des riblons et du charbon, pour la
réduction de la prise d'azote durant la coulée
à partir d'un EAF et pour brasser le mélange au
niveau de la sole,
- Dans la métallurgie non ferreuse, le dioxyde de carbone
sert à supprimer les fumées pendant le transfert de
matte (production de Cu / Ni) ou des lingots de métal
précieux (production de Zn / Pb) dans la poche de
coulée,
- De petites quantités de CO2 liquide peuvent être
utilisées dans les procédés de recyclage des
eaux provenant des drains des mines,
- Les lasers CO2 sont alimentés par du gaz carbonique
à pureté adaptée.
Laboratoires et analyses
Le CO2 est la phase mobile dans des procédés
d'extraction ou de chromatographie en phase supercritique.
Électronique
Le dioxyde de carbone est généralement
employé dans le traitement des eaux usées ou en tant
que milieu de refroidissement durant les essais climatiques des
composants électroniques.
Il peut servir à augmenter la conductivité de l'eau
ultra-pure ou pour le nettoyage abrasifs de pièces sous forme
de neige carbonique et dans le procédé propre de
nettoyage des résines photosensibles au CO2 supercritique afin
d'éviter l'utilisation de solvants organiques.
Environnement
L'injection de dioxyde de carbone permet de maîtriser le pH des
effluents aqueux. Le CO2 est une excellente alternative au
contrôle du pH par l'acide sulfurique.
Autres industries
Neige carbonique pour extincteurs.
Contrôle et régulation du pH des eaux usées,
piscines, etc
MODE D'APPROVISIONNEMENT :
Le dioxyde de carbone peut être distribué :
- en bouteille,
- dans des réservoirs de gaz liquéfié,
- sous forme solide (la glace "sèche" ou Carboglace),
Nota : la glace carbonique se sublime en ne laissant aucun
résidu, et produit rapidement une grande quantité de
froid ( 150 fr/h/kg à -78,5°C ) - Rappel : 1 frigorie
(fr) = -4,185.106 joules, et exacte opposé de la
thermie (th) ou Mcal.
Risques majeurs :
- Produit sous Haute pression; inhalation
- Toxicité (Am. Conf. Of Gov. Ind. Hygienists ACGIH 2000
Edition) : 5000 ppm
- Limites d'inflammabilité dans l'air (conditions
normales TPN) : Ininflammable
- Odeur : Aucune
- Code UN : UN1013 (gaz); UN2187 (liquide
réfrigéré); UN1845 (solide)
- EINECS Number : 204-696-9
- Code US pour le transport (DOT Label) : NFG
- Classe de risque USA (DOT Hazard class) : Gaz
ininflammable
Lien
(canadien) sur les effets du CO2 sur la santé.
FICHE TOXICOLOGIQUE (INRS) :
fichier pdf à
télécharger éventuellement (71 ko).
>>> Site du BRGM (captage/stockage
du CO2).
 - Retour
: veuillez utiliser celui de votre navigateur, par
exemple >
- Retour
: veuillez utiliser celui de votre navigateur, par
exemple >

Sources d'une partie de ce document : >>> Air Liquide
 ...
...





 - Retour
: veuillez utiliser celui de votre navigateur, par
exemple >
- Retour
: veuillez utiliser celui de votre navigateur, par
exemple >