GÉNÉRALITÉS
:
Le gaz, sulfure d'hydrogène (ou hydrogène
sulfuré), est le résultat de la combinaison
de deux éléments : l'hydrogène H et le
soufre S, soit la formule
H2S .
Masse moléculaire 31,08 g
mol-1.
Appelé également : hydrure de soufre, monosulfure de
dihydrogène ou sulfure de dihydrogène, le sulfure
d'hydrogène est un hydrure à l'odeur
désagréable d'œuf pourri.
C'est un gaz acide qui réagit
avec les solutions aqueuses basiques et les métaux tels que
l'argent. C'est la raison pour laquelle les bijoux argentés
noircissent lorsqu'ils sont longuement exposés à
l'atmosphère polluée. Le sulfure d'argent
résultant de la réaction est de couleur noire.
Le sulfure d'hydrogène (l'hydrogène
sulfureux) est produit par la dégradation des
protéines contenant du soufre et est responsable d'une grande
partie de l'odeur fétide des excréments et des
flatulences. Il peut résulter de décomposition
bactérienne de la matière organique. Il est
également produit par les déchets humains et animaux.
Il peut donc s'accumuler dans les réseaux d'assainissement et
corroder les tuyaux qu'ils soient en béton ou en métal.
Il peut faire suffoquer les égoutiers.
Le sulfure d'hydrogène est naturellement présent dans
le pétrole, le gaz naturel, les gaz volcaniques et les sources
chaudes. Le sulfure d'hydrogène peut également provenir
des activités industrielles, telles que la transformation des
produits alimentaires, du traitement des eaux usées, des
haut-fourneaux, des papeteries, des tanneries et des raffineries de
pétrole.
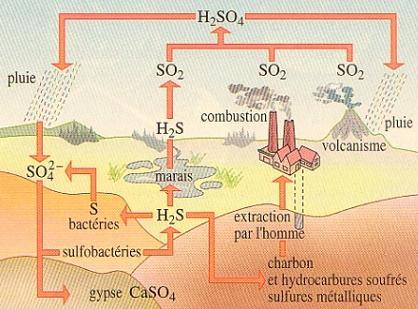
La plus grosse partie du sulfure d'hydrogène dans
l'atmosphère provient de sources naturelles : eaux
sulfurées, marais salins et zones d'activité
géothermique, volcanisme. Le niveau ambiant pour le sulfure
d'hydrogène est estimé à 0,3 µg/m³.
Dans les environs de la ville de Rotorua (Nouvelle Zélande),
ville proche de zones à forte activité
géothermique, les concentrations en sulfure d'hydrogène
sont suffisantes pour provoquer des odeurs, et on mesure
jusqu'à 80 µg/m³ durant 55 % des mois d'hiver. Des
concentrations bien plus importantes ont même été
mesurées dans les environs de papeteries (plusieurs centaines
de µg/m³).
Cycle géochimique des composés du soufre
:

Comme le sulfure d’hydrogène pose plus de
problèmes de nuisances olfactives que de réels
problèmes de santé publique, il est intéressant
d’envisager le nombre de dépassements du seuil
olfactif.
Dans la littérature scientifique, les valeurs citées
pour le seuil de perception du sulfure d’hydrogène
varient fortement suivant les sources. Aussi, mon choix s’est
porté sur la valeur de 7 µg/m³ sur ½ heure
recommandée par l'O.M.S., en gardant à l’esprit
que certaines tranches de la population pourront percevoir
l’H2S à des teneurs plus faibles,
alors que d’autres ne sentiront rien !
Propriétés.
Gaz à odeur désagréable d'œuf
pourri.
Inflammable, il se décompose en brûlant, et en en
présence d'un excès d'oxygène, la combustion est
totale :
(production de dioxyde de soufre SO2 , lien).
Très toxique par inhalation.
Aux conditions "normales" de pression, c'est un gaz plus lourd que
l'air (1,45 kg m3-1 à
15°C).
Il se liquéfie à T = -60,2 °C (P =
1atm). C'est aussi le point d'ébullition du
gaz liquide.
Le point de fusion du sulfure d'hydrogène solide (glace
d'H2S) est de -86°C (187
K), et donc c'est aussi le point de solidification du
H2S liquide.
Le Point Triple se situe à -85,5°C (P = 227 hPa).
Le Point Critique (Critical point
•) se situe
à P =8,937 MPa ( 89,37 bar) et Tc = 100
°C [273,15 K]
.
L'H2S se transporte habituellement à l'état
liquide dans des cylindres d'acier sous pression.
Diagramme de phases des formes du système H2O
/ H2S :

Clés : LA > liquide aqueux, I > glace,
LS > liquide enrichi en H2S, H > hydrate d'H2S, V > vapeur,
TP > Point Triple, CP > Point Critique,
Q1 et Q2 > Points quadruple, K > point triphasé critique
final.
Un point intéressant à noter dans ce
diagramme est que l'hydrate de sulfure d'hydrogène peut
exister aux températures autour de 30°C. De tous les
composants généralement trouvés dans le gaz
naturel, l'hydrate du H2S peut donc y être
trouvé à température ambiante.
--------------------------
Sources : FlowPhase Inc. #330, 2749 - 39 Avenue NE - Calgary,
Alberta, CANADA.

Nota (rappel, acides [HA]) :

et,

pK1 = 7 (50% de
H2S et 50% HS-) et
pK2 = 12,3 (50% de
HS- et 50%
S2-).
NB - à pH < 4, H2S = 100%, et à pH
> 9.5, HS- = 100%.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
au bout de 2–15 minutes |
|
|
au bout d’une heure |
|
|
au bout de 30–60 minutes |
|
|
arrêt de la respiration et mort |
|
|
asphyxie foudroyante |