
(tartre récupéré)
|
|
Notions fondamentales relatives
à l'équilibre des
eaux.
NOTIONS D'EQUILIBRE
Quelques considérations générales
Mettre une eau à l'équilibre, c'est lui donner, par
un traitement approprié, des caractéristiques stables
dans le temps qui s'écoule entre son stockage après
traitement et son utilisation par le consommateur.
L'équilibre de l'eau dépend de deux facteurs :
La recherche de cet équilibre nécessite la mise en oeuvre de deux moyens d'action :
Il va de soi que s'il s'agit d'installations anciennes,
l'équilibre de l'eau ne peut être obtenu que dans
l'amélioration des caractéristiques de celle-ci et non
dans le choix des matériaux qui n'a d'objet que s'il s'agit
d'installations nouvelles.
Les inconvénients consécutifs à un défaut
d'équilibre des eaux sont dus à :
Dans les deux premiers cas, les ouvrages et équipements concernés sont endommagés et même détruits et l'eau acquiert turbidité et coloration. Dans le dernier cas, les canalisations sont rétrécies, parfois même obstruées et ne transitent plus les débits prévus.

EQUILIBRE IONIQUE DES EAUX
Rappel des composants essentiels de l'eau :
Rappel des éléments fondamentaux.
Rappel des éléments caractéristiques.
Ce sont les ions autres que les précédents. Ils
peuvent se trouver ou non dans l'eau à laquelle ils
confèrent son caractère particulier, par exemple :
Alors que les éléments fondamentaux sont toujours
présents dans les eaux naturelles, les éléments
caractéristiques ne le sont pas toujours.
Rappel des définitions essentielles.
Relations fondamentales de
l'équilibre ionique.
Les concentrations en ions ou moles sont liées entre elles
par les relations fondamentales suivantes :
- (H+) + 2(Ca2+) + A = (OH-) + 2(CO32-) + (HCO3-) + C
unité : mole ou millimole/litre, dans laquelle :
- A = 2[SO42-] + [Cl-] + ... (autres anions)
C = 2[Mg2+] + [Na+] + [K+] + ... (autres cations)
(2) H2CO3 <> H+ + HCO3-.........d'où, à l'équilibre : [H+][HCO3-][H2CO3] = K'1
(3) HCO3- <> H+ + CO32-...........d'où, à l'équilibre : [H+][CO32-][HCO3-] = K'2
K'e, K'1 et K'2 sont des constantes pour une température donnée et pour une force ionique donnée (la force ionique est une fonction des concentrations et des valences des ions présents dans la solution donc de la minéralisation).
Si la solution est saturée en carbonate de calcium, l'application de la loi d'action de masse à l'équilibre hétérogène,
CaCO3 <<< >>> Ca2+ + CO32-conduit à la relation (4) :
[Ca2+] [CO32-] = K'sK's étant une constante, à température donnée, et pour une force ionique donnée.
En pratique, les relations ci-dessus se simplifient car on s'aperçoit qu'en tenant compte des valeurs des constantes, certaines concentrations ont, selon le cas étudié, une valeur négligeable. C'est le cas des valeurs de (H+) ou (OH-) dont l'une ou l'autre ou les deux simultanément sont négligeables. Cette dernière éventualité se produit notamment à l'équilibre chimique pour lequel :
[H+] = [OH-] = 10-7
Notons au passage que l'eau est neutre chimiquement à pH 7
et à une température voisine de 23 °C. A une
température différente, le pH de neutralité
chimique s'écarte de la valeur ci-dessus. Quoi qu'il en soit,
cette neutralité chimique n'est pas le signe d'une eau
à l'équilibre carbonique.
C'est aussi le cas des valeurs de (H2CO3),
(HCO3-) ou (CO32-) dont
l'une au moins ou deux d'entre elles sont négligeables. Ces
trois concentrations sont les termes de ce que l'on pourrait appeler
le CO2 total.
Il existe des méthodes qui comportent à la fois des
calculs et des représentations graphiques qui permettent
d'étudier de façon relativement simple et rigoureuse
les équilibres des eaux naturelles.
Nota : les quatre relations entre les six concentrations des
éléments fondamentaux permettent d'envisager un
graphique rapporté à deux axes de coordonnées
relatifs chacun à un élément fondamental ou
à une fonction de ces éléments. Chaque point du
graphique représente alors une eau parfaitement
déterminée;
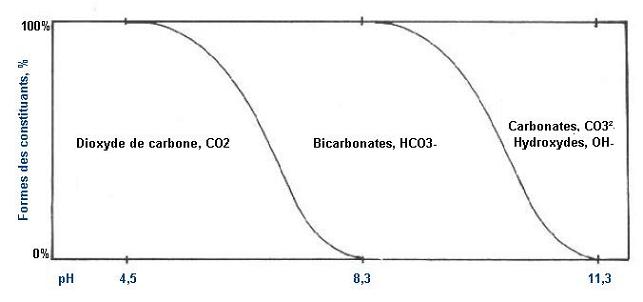
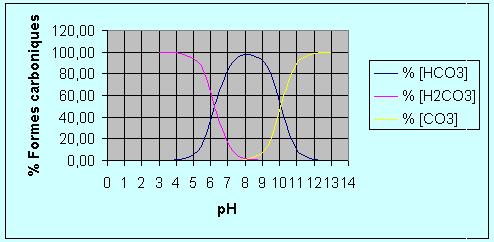
Exemple : des relations (2) et (3), nous pouvons
déduire la répartition de l'équilibre
fondamental:
H2O + CO2 <<< >>> H+ + HCO3-
Nota : H2O + CO2 = [2 H+,
CO32-] ou acide carbonique,
H2CO3
% des formes de constituants des équilibres du
CO2 et de l'alcalinité en fonction du pH (eau pure)
:
Directives officielles.
( selon la Circulaire NDGS/SD7A no 2007-39 du 23 janvier 2007
relative à la mise en oeuvre des arrêtés du 11
janvier 2007 concernant les eaux destinées à la
consommation humaine > modifications apportées ).
d) L’équilibre calcocarbonique : la
référence de qualité est précisée
dans l’arrêté : les eaux doivent être
à l’équilibre calcocarbonique ou
légèrement incrustantes.
Il est considéré que cette référence de
qualité est satisfaite lorsque ;
avec pH in situ : pH mesuré sur site, et pHeq : pH d’équilibre
Paramètre relatif à l’équilibre calcocarbonique dans la base de données SISE-Eaux (code CALCOC2) sont modifiées de la manière suivante (5 classes de qualité) :
Méthodes
de calcul.
Le calcul des concentrations des éléments
fondamentaux est possible dès que l'on connaît certaines
valeurs caractéristiques de couples tels que pH et TAC ou pH
et CO2 total ou [Ca2+] et CO2 total,
ceci permettant de déterminer l'équilibre
calcocarbonique.
De nombreuses méthodes ont été
proposées par différents auteurs : méthodes
graphiques et/ou par calcul nécessitant un
micro-ordinateur.
En particulier :
Nota : dans ces programmes, les traitements classiques sont
simulés.


>>> Voir également ces pages sur le traitement de l'équilibre.
Bibliographie :
- avoir une concentration convenable en ions calcium pour que le dépôt en question soit suffisant sans être excessif,
- ne pas contenir une trop forte proportion d'ions
SO42- ou Cl- qui pourraient
rendre le dépôt poreux, donc inefficace,
- être à pH aussi élevé que possible
afin que sa corrosivité vis-à-vis des
métaux soit minimale,
- contenir de 4 à 5 mg/l d'oxygène qui
conditionnent dans l'attaque des métaux la vitesse de
précipitation des dépôts
insolubles.
Pour satisfaire à ces conditions, le TH (dureté)
sera entre 8 et 15°F, le TAC de l'ordre de 7 à 10
°F, le pH supérieur à 7,2 et au moins
égal au pH dit de saturation (pHs), et ne pas contenir de
gaz carbonique en excès (CO2
agressif).
L'indice de saturation IS (pH - pHs) doit donc être
compris entre 0 et 0,1,
(en anglais, Langelier Saturation Index ou
LSI).
Les classes suivantes sont généralement
adoptées pour caractériser la dureté de
l’eau :
Echelle de dureté :
 soit,
soit,
ACTION DE L'EAU, NON EQUILIBREE,
SUR LES METAUX.
La corrosion est une série complexe de réactions entre
l'eau et les métaux et les matériaux dans lesquels
l'eau est stockée ou transportée.
La principale préoccupation concerne la présence
potentielle des métaux à caractère toxique ,
tels que le plomb et le cuivre; la détérioration et les
dommages à la plomberie domestique, et des problèmes
esthétiques tels que: le linge souillé, le goût
amer et les taches bleu-vert autour des bassins et des drains.
Le principal problème de santé est le potentiel de
présence de niveaux élevés de plomb et de cuivre
dans l'eau. En raison des préoccupations liées au
plomb, il est interdit l'utilisation de brasures à forte
teneur en plomb. La principale source de cuivre est la lixiviation du
cuivre dans les propriétés. Dans certains cas, le
système de plomberie doit être remplacé et
remplacé par une tuyauterie en PVC, PEX ou d'autres
matériaux.
La corrosion se produit n'importe où dans la cellule ou le
champ galvanique peut être ou a établi. Pour
établir le champ qui doit être des métaux
dissemblables qui sont connectés directement ou indirectement
par un électrolyte, comme l'eau. C'est la même
réaction chimique qui se produit dans une batterie.
Presque tous les métaux vont se corroder dans une certaine
mesure. Cela dépend des caractéristiques physiques et
chimiques des milieux, du métal et de l'environnement. Dans
l'eau qui est douce, la corrosion se produit en raison de l'absence
de cations dissous, tels que le calcium et le magnésium dans
l'eau. En formant de l'eau plus dure, un précipité ou
un revêtement de carbonate de calcium ou de magnésium se
forme à l'intérieur de la tuyauterie (cela peut aussi
obstruer un tuyau...).
L'eau avec des niveaux élevés de sodium, de chlorure ou
d'autres ions augmentera la conductivité de l'eau et
favorisera la corrosion. La corrosion peut également
être accélérée par :
Le coût de la corrosion peut être coûteux, car une corrosion :
Le phénomène électochimique primaire est la formation de piles locales dues à l'ionisation, au contact de l'eau, du métal non protégé, qui perd, soit des électrons, soit des ions :
Les réactions primaires sont :
Les plages anodiques sont attaquées et le
phénomène se poursuit s'il y a, c'est en
général ce qui se produit, dépolarisation des
électrodes. Cette dépolarisation peut être due
notamment au mouvement de l'eau qui empêcherait, en
l'absence de phénomènes secondaires, tout
équilibre de se produire, ou à l'oxygène
dissous qui élimine l'hydrogène dégagé
à la cathode.
Ce phénomène est donc provoqué par tout
défaut d'homogénéité dans le milieu,
qu'il s'agisse :
INDICES DE CORROSION.
Les principaux indices utilisés en France actuellement sont
:
- l'indice de Ryznar,
- l'indice de Larson.
1 - Indice ou Index de Ryznar IR :
Appelé également, indice de stabilité
(en anglais, Ryznar Stability Index ou RSI),
calculé par la formule simple (2 pHs-pH) , il donne une
indication de la tendance corrosive ou incrustante (entartrante) de
l'eau.
Ci-joint le tableau donné par l'auteur :

Indication de tendances corrosives retenues :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

Pour le fer, les zones de potentiel Eh et de pH délimitant
les trois états ci-dessus sont souvent définies par le
diagramme de Pourbaix :

((lien
wikipedia).
Un grand nombre des métaux utilisés en construction
sont suffisamment réactifs avec l’eau pour rendre
difficile ou impossible la création d’un état
d’immunité. C’est pourquoi la protection
anticorrosion fait souvent appel à la création
d’un état de passivation, ce que l’on obtient soit
par les qualités inhérentes du matériau
(ex. acier inoxydable), soit par la
modification de la composition du fluide corrodant
(ex. reminéralisation pour protéger les
réseaux d’eau potable – voir passivation de l'acier
au carbone par les eaux naturelles et
neutralisation-reminéralisation).
Il apparait que les problèmes de corrosion sont très
difficiles à cerner, surtout par des calculs simples ne
faisant appel qu’à quelques éléments tels
que pH et pHs, et en négligeant d’autres processus
chimiques ou électrochimiques. Et bien évidemment
certains calculs ne prétendent pas les résoudre, mais
donne seulement des indications.
2 - Indice de Larson :
Permet le calcul de l'indice de corrosion des
métaux, selon Larson (en anglais, Larson
Ratio ou LR).
Les valeurs seront exprimées en moles/litres.
Interprétation du résultat
(propositions personnelles) :
(selon Larson, tendance à la
corrosion si LR>0.5)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|