Introduction.
Ce chapitre ne donnera qu'un aperçu des traitements permettant d'obtenir une eau potable à partir d'une eau brute : eau d'origine souterraine ou de surface.
Les procédés seront évoqués dans leurs grandes lignes, en conformité avec la garantie de confidentialité des procédés brevetés ou non par des sociétés.
Certains étant rentrés dans le domaine public (livres, brochures, articles, web) pourront être plus détaillés.
Les schémas ne pourront être que des schémas de "principe".
Nota : au niveau des systèmes et du matériel, ce chapitre est loin d'être exhaustif...
FILIÈRE COMPLÈTE DE
TRAITEMENT
Le traitement à appliquer aux eaux destinées à
l'alimentation humaine consiste dans la majorité des cas
à les débarrasser de toutes les matières en
suspension et colloïdales qu'elles contiennent ainsi que de
certaines substances dissoutes.
Pour atteindre ce but, il est généralement
nécessaire de combiner plusieurs opérations
élémentaires mettant en oeuvre des
phénomènes physiques, chimiques et biologiques.
Par ailleurs, il convient parfois de corriger certaines
caractéristiques de l'eau résultant des modifications
apportées par les traitements ou préexistantes.
La chaîne ou filière de
traitement la plus complète comportera:
Prétraitement :
Clarification :
Au cours de l'étape de
clarification des eaux brutes, les matières en
suspensions et colloïdes, principales responsables de la
turbidité, sont extraites.
Dans sa forme complète, le processus de clarification fait
appel aux procédés de séparation liquide-solide
: décantation et filtration, qui seront
précédés, pour les particules les plus fines
essentiellement les colloïdes, de traitement de
précipitation et de croissance de ces particules : la
coagulation, floculation.
De type physico-chimique, ces deux procédés ont pour
but de créer avec les colloïdes, des agrégats
suffisamment lourds pour qu'ils puissent être
séparés du liquide par simple décantation.
En fait, la coagulation-floculation-décantation introduite
depuis quelques décennies, revêt une très grande
importance :
• 90% au moins des matières en suspension sont extraits à ce niveau du traitement.
• Une coagulation incomplète des matières colloïdales contenues dans l'eau se répercutent d'une manière néfaste sur toutes les étapes suivantes du traitement ; des particules colloïdales ne sont en effet pas retenues sur les filtres, elles gênent alors considérablement la stérilisation et nuisent enfin aux caractères organoleptiques de l'eau (couleur et turbidité notamment).
• Une décantation insuffisante peut conduire à un colmatage rapide des filtres, limitant ainsi considérablement la quantité d'eau produite entre deux lavages.
• Une grande partie des micropolluants
contenus dans l'eau sont en fait absorbés sur les particules
colloïdales. L'élimination des colloïdes conduit
donc à l'élimination d'une partie des
micropolluants.
La coagulation de ces particules s'accompagne en outre d'un effet
complémentaires d'adsorption des micropolluants dissous
d'origine organique, tels que les pesticides, ou minérale tels
que les métaux lourds par exemple.
II faut noter qu'exceptionnellement, si la turbidité de l'eau
brute est faible (au-dessous d'environ 10 NTU) ainsi que la
quantité de matières organiques, la phase de
décantation peut être supprimée et l'eau brute,
additionnée de réactif coagulant, directement admise
sur les filtres mono-couches ou éventuellement
multi-couches.
Par ailleurs, il existe, en sens inverse, une limite supérieure de la teneur en matières en suspension, variable suivant le modèle de décanteurs, et au-delà de laquelle il est indispensable de prévoir en amont du décanteur un étage de débourbage ou de dessablage (suivant la taille des particules à éliminer).
Le but est d'éliminer le gaz carbonique
(CO2)
agressif* des eaux, et
d'augmenter si nécessaire l'alcalinité (TAC) et/ou la
dureté (TH) de ces eaux dites "agressives".
Trois types de traitement sont envisageables :
*Rappel : le CO2
agressif (vis à vis des carbonates) correspond à la
fraction du CO2 libre dissous dans l'eau, en
excès par rapport aux ions carbonate/bicarbonate
[CO3]/[HCO3],
et le CO2 qui est en équilbre de liaison avec ces
ions (CO2 dit équilibrant).
(voir éventuellement > cette
page sur les équilibres).
Traitement par aération
(élimination du gaz carbonique
CO2).
Procédé physique, utilisé uniquement si le
CO2 est élevée et pour lequel les
quantités de réactifs neutralisants seraient
prohibitives.
Techniques possibles :
>>> raccourci
vers les méthodes de traitement par aération
(préoxydation physicochimique).
Traitement
par neutralisation.
Procédé chimique, qui permet l'élimination du
CO2 agressif par réaction de neutralisation avec un
réactif basique (xOH),
Formule simplifié principale : CO2 +
xOH- >>>
x[HCO3-]
NB : pas d'action sur la dureté calcique (le calcium est
inchangé)..
Remarque : la neutralisation si elle se veut complète, ne se
poursuit pas jusqu'à la disparition complète de l'acide
carbonique [CO2, H2O] contenue dans l'eau : l'arrêt de
l'action neutralisante est à l'équilibre de
saturation du carbonate de calcium [CaCO3] de l'eau, ou
équilbre calco-carbonique. Si l'on continue à ajouter
du réactif, il se produira alors un adoucissement de l'eau par
précipitation du CaCO3 car celui-ci, en excès, ne peut
rester solubilisé et donc se dépose (dans les
conditions de concentration atteintes). A ce point, le CO2
résiduel est dit équilibrant, et n'est donc plus
considéré comme du CO2 agressif.
Principales techniques possibles (formules) :
(cliquez sur le nom du réactif pour obtenir
plus de renseignements)
Remarques :
- en ce qui concerne la fltration sur calcaire, l'action de
neutralisation est relativement lente (par rapport à
l'injection de réactifs en solutions), et par ailleurs diminue
en efficacité au fur et à mesure de la diminution de la
teneur en CO2; il est donc nécessaire de prévoir des
filtres importants,
(voir donc aussi les programmes de dimensionnements
Neutral
et
Neutral-F
> lien
interne).
- Circulaire
DG 5/VS 4 n° 2000-166 du 28 mars 2000 relative aux produits
de procédés de traitement des eaux destinées
à la consommation humaine.
Doses de produits en mg (purs 100%)
pour 1 mg de CO2 agressif neutralisé
(en mg/mg ou
g/m3) :
|
|
|
|
|
|
|
|
|
|
|
|
Augmentation de l'alcalinité (TAC), et de la dureté totale (TH), selon le réactif employé (en °F par mg de CO2 éliminé) :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Type de produits utilisables en filtration neutralisante
:

Caractéristiques de certains produits utilisables :

Cas particulier :
Neutralisation au bicarbonate de sodium,
NaHCO3 +
CO2 + H2O >>> 2 NaHCO3
Dans ce cas il y a une constance de la teneur en CO2
libre de l'eau : transformation du CO2 agressif en CO2
équilibrant, et formation de NaHCO3, donc augmentation du TAC
(on peut aller jusqu'à l'équilibre de
saturation au CaCO3).
Dose de produit en mg (purs 100%) pour
1 mg de CO2 agressif "transformé"
(en mg/mg ou
g/m3) :
|
|
|
|
|
|
Augmentation de l'alcalinité (TAC) et du TH (en °F par mg de NaHCO3 injecté) :
|
|
|
|
|
|
Réactifs qui agissent uniquement sur
la dureté calcique (pas de
neutralisation du CO2) :
Augmentation de la dureté TH, selon le réactif employé (mg de réactif pur anhydre à injecter pour 1°F augmenté) :
|
|
|
|
|
|
|
|
NB :
Les doses indiquée sont pour un réactif à 100%
de pureté et il est nécessaire de corriger cette dose
en tenant compte de la pureté (en
réactif pur 100%) du produit commercial.
CORRECTION DES DOSES EN FONCTION DU PRODUIT
COMMERCIAL :
Quantité en masse (poids) de produit commercial :
Quantité en volume de produit commercial :
Avec,
EXEMPLES.
Exemple 1 :
Dose théorique Dt de chaux Ca[OH]2
indiquée = 30 g/m³ d’eau,
ou,
Quantité en poids de chaux solide commerciale (Qm) : (100/90,9)30 = 33 g/m³ d’eau,
Quantité en volume de chaux en solution (Qv) : (1/1,65 x 30) = 18,19 litre / m³ d’eau.
Exemple 2 :
Dose théorique Dt de carbonate de sodium Na2CO3
indiquée = 40 g/m³ d’eau,
ou,
Quantité en poids de carbonate de sodium solide commercial (Qm) : (100/96)40 = 41,7 g/m³ d’eau,
Quantité en volume de carbonate de sodium en
solution (Qv) : (1/50 x 40) = 0,8 litre / m³ d’eau
(800 ml/m3)
Exemple 3 :
Dose théorique Dt de soude NaOH indiquée = 25
g/m³ d’eau,
Quantité en poids de soude commerciale (Qm) : (100/30)25 = 83,3 g/m³ d’eau
Quantité en volume de soude
commerciale (Qv) : (1 / 1328 x 83,3) = 0,0627 litre / m³
d’eau (ou 62,7 ml/m3).
............................................................ou (Qv) :
(1 / 398,4 x 25) = 0,0627 L/m³.
Traitement par
REMINÉRALISATION.
Les traitements élémentaires de neutralisation
précités ne permettent pas de conférer les
caractéristiques optimales souhaitées à toutes
les eaux. C'est le cas des eaux douces contenant peu ou pas de gaz
carbonique, ainsi d'ailleurs que des eaux sursaturées à
pH supérieur à 8,3.
Pour obtenir le résultat souhaité, il est
nécessaire d'appliquer à ces eaux un traitement de
reminéralisation qui leur conférera une
minéralisation supérieure à celle que l'on
obtiendrait par un traitement élémentaire de
neutralisation carbonatée ou non.
Reminéralisation par injection de CO2
suivie d'une neutralisation par réactifs
neutralisants.
En général, il est procédé
à l'injection de gaz carbonique (CO2)
dans l'eau, avant l'introduction ou de filtration par réactif
neutralisant.
Ceci s'effectue à la base de colonnes ou de cuves
spécialement aménagées : le CO2 est
injecté par de simples tubes ou mieux par des buselures
calibrées ou des diffuseurs poreux.
On obtient donc de l'eau acidulée contenant donc une certaine
quantité d'acide carbonique (CO2+H2O) dans laquelle le produit
basique (neutralisant de cet acide) sera introduit, ou l'eau acide
sera ensuite envoyée sur un filtre à base alcaline pour
y être neutralisée :
Filtres à base de carbonate de calcium :
Nota : une consommation de la masse filtrante sera donc
effectué en fonction de la quantité de CO2 agressif
présent dans l'eau acide et du % en CaCO3 de cette masse.
NOTA - Solubilité du
CO2 :
La solubilité du dioxyde de carbone (gaz carbonique)
dans l'eau, dépend de la température et de la pression
partielle de ce gaz au-dessus de l'eau.
Soit, par exemple, ci-dessous la quantité de dioxyde dissous
dans l'eau pure, au maximum (en mg/l), sous pression de CO2 =
pression atmosphérique.
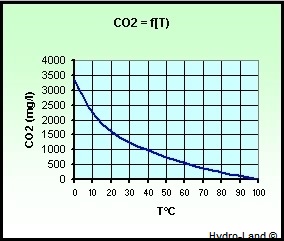
Notons les valeurs maximum suivantes :
< Nota : lien
interne sur le CO2 >
Reminéralisation par injection de
bicarbonate de soude et d'un sel fort de calcium.
Ce traitement concerne les eaux douces à faible teneur
mais néanmoins sursaturées en CO2 libre.
L'injection de bicarbonate de soude "transforme" le CO2 agressif en
CO2 libre. Il est possible que la seule action du bicarbonate
permette d'atteindre la zone d'équilibre souhaitée.
Le traitement doit être complété (ou
précédé) par une adjonction de sels forts de
calcium, le sulfate de calcium ou le chlorure de calcium, dont
l'utilité est :
Conclusion sur les traitements de
reminéralisation.
* Le procédé idéal est l'injection de CO2,
suivie d'une neutralisation.
On peut faire au sujet de cette technique, les observations suivantes
:
- elle ne met en oeuvre que des produits présents dans pratiquement toutes les eaux naturelles et dont l'action ne saurait être mauvaise
- elle est cependant plus complexe que l'autre technique envisagée puisque, pour agir séparément sur le TAC et le TH, il faut deux réactifs en plus du CO2.....
* La technique par injection de bicarbonate de soude et d'un sulfate ou d'un chlorure de calcium est valable dans la mesure où, à l'issue de ce traitement, l'eau ne contient pas trop d'ions sulfates (SO42-) ou chlorures (Cl-) qui favorisent l'attaque des matériaux même à des teneurs très inférieures aux limites autorisées. L'opportunité du procédé et les taux de traitement seront examinés en tenant compte :
VARIANTE POSSIBLE DU
TRAITEMENT :
L'injection de CO2 est toujours associée à une
neutralisation, sauf bien entendu, s'il s'agit d'une eau
sursaturée. De plus, ce traitement doit souvent
s'insérer dans un traitement complet de
coagulation/floculation (processus d'agglomération et de
précipitation des particules
En ce cas, il y a plusieurs possibilités :
Cette dernière manière de procéder, n'est possible que sur les eaux dont le TAC est assez faible pour qu'il n'y ait pratiquement aucune décarbonatation. Son intérêt est double :
- le CO2 est très facilement retenu dans l'eau qui contient alors essentiellement de la chaux et un peu de carbonate.- le contrôle du traitement s'opère en vue d'obtenir un pH déterminé en agissant sur le débit de gaz carbonique beaucoup plus facile à régler que celui de la chaux. La qualité de la régulation est très améliorée si l'injection de CO2 se fait en dernier, juste avant prélèvement de contrôle du pH.
Notons également que si l'injection de CO2 est faite avant l'entrée d'une filtration, il faut éviter toute chute à l'entrée sur ces derniers pour éviter le dégazage.
Remarques finales.
Des difficultés sont quelquefois rencontrées
pour amener les eaux à l'équilibre parfait :
* Si cet équilibre est obtenu par l'injection d'un réactif, le dosage de celui-ci doit être très précis après avoir été déterminé en fonction des caractéristiques de l'eau en fin de traitement. Toute erreur due à un dosage défectueux ou à une modification des caractéristiques de l'eau peut conduire à une eau agressive ou entartrante.* Une eau trop douce, même équilibrée vis-à-vis du calcaire, ne produira pas un dépôt protecteur souhaité de carbonate de calcium, à moins d'un traitement de recarbonatation que l'on hésite parfois à adopter.
* Il est, en pratique, difficile de conserver à l'équilibre, une eau qui le serait au départ de l'usine de traitement.
En effet, toute modification de température rendra cette eau , dans le réseau ou chez l'abonné, soit agressive, soit incrustante.* Une eau, même parfaitement équilibrée, peut demeurer corrosive à l'égard des métaux et les inconvénients qui en résultent durent tant qu'un dépôt protecteur n'aura pas revêtu la totalité des surfaces métalliques au contact de l'eau.
Pour ces raisons, on complète parfois les traitements
d'amenée à l'équilibre exposés
précédemment par un traitement d'inhibition qui
paralyse, en quelque sorte, la capacité agressive ou
entartrante de l'eau.
Bibliographie.
(Concernant l'ensemble des textes sur les équilibres)
-W.F. LANGELIER. Analytical control of anticorrosion water treatment.
J.A.W.W.A., 18, (1936), 1500
-LANGELIER. Étude de l'indice de saturation. Influence de la
température. J.A.W.W.A., 38, (1946), 179-189
-L. LEGRAND, G. POIRIER. Théorie des eaux naturelles. Eyrolles
Ed., 1972
-L. LEGRAND, G. POIRIER, P. LEROY. Les équilibres carboniques
et l'équilibre calcocarbonique dans les eaux naturelles.
Eyrolles Ed., 1981
-C.P. HOOVER. Practical Application of the Langelier methods.
J.A.W.W.A., 30 (11), (1938), 1802.
-FRANQUIN, MARECAUX. 18e congrès de chimie industrielle.
Nancy, (1938), 229-237
-L. COIN. Détermination de l'agressivité des eaux
naturelles. Ann. d'Hyg. publ. industrielle et sociale. XX, (5),
(1942), 145
-COLAS. L'eau. 6, 7, 7 (1949), 105, 121, 133
-HALLOPEAU. L'acide carbonique dans l'eau. T.S.M. (1949). 1-11
-R. COLAS. Les eaux douces. CBEDE, 37, (1953), 161
-Cl. SCHMITT. Thèse Fac. Sci. Rennes, (1955) et l'eau, 11,
(1956), 143-249.
-J. HALLOPEAU. Les équilibres carboniques dans les eaux.
Terres et Eaux n°35. 1960-61. -R. GIRARD. Méthode
d'étude d'une eau naturelle à partir de son
analyse,
L'eau, n°5 (1967), 199
-I.G. FAUGERE. Interprétation pratique des résultats
analytiques relatifs à l'agressivité de l'eau et
à l'entartrage. Prod. Pharm., vol. 24, n°9, (1969),
491.
|
|