
(d'après R. Bichac)
Hydrogène et Oxygène >
Introduction.
De nombreuses équipes de chercheurs réalisent des
séries d'expériences, elles prolongent celles
effectuées depuis des décennies concernant les
différentes phases de l'eau solidifiée : la
glace.
Glaciation.
Si l’on refroidit l’eau liquide, l’agitation
thermique* des molécules
d’eau diminue progressivement et les liaisons
hydrogènes, qui pouvaient aisément se tordre dans
le liquide, se raidissent progressivement pour devenir pratiquement
rectilignes (droites). Les molécules d’eau forment alors
une structure rigide très organisée :
l’eau s’est transformée
en glace.
* Mouvement
incessant dont sont animés les atomes ou molécules qui
constituent la matière, et ce quel que soit l\'état
gazeux, liquide ou solide, dans lequel elle se trouve. Ce mouvement
est d\'autant plus énergique que la température est
élevèe.
Alors que dans l'eau liquide l'agitation thermique
résiduelle permettait aux liaisons hydrogène de se
tordre, donnant aux molécules d’eau une certaine
liberté de mouvement, au sein de la glace, l’agitation
thermique des molécules d’eau est réduite au
minimum : les molécules ne peuvent plus changer de position,
elles ne peuvent que vibrer autour de cette position. Elles forment
un ensemble structuré où chaque atome
d’oxygène est au centre d’un tétraèdre
dont les sommets sont occupés par les atomes
d’oxygène des 4 molécules d’eau voisines
:

or, l'un des arrangements tetraédriques les moins compacts
est la structure hexagonale, mais cette configuration
crée des "trous" dans la glace, qui devient du coup, moins
dense que l'eau liquide : la masse volumique de la glace est donc
inférieure à celle de l'eau.
Egalement, contrairement à tous les autres corps, la
température de fusion de la
glace diminue quand la pression augmente : un autre
comportement tout à fait étonnant, car le
phénomène est différent pour la plupart des
autre corps solides.
Autrement dit, si l'on comprime la
glace sans la réchauffer : elle fond
(ce qui arrange les patineurs !).
Ce sont encore les liaisons hydrogène qui sont à
l’origine de ce phénomène : sous
l’effet d’une compression, celles-ci, en effet,
s'affaiblissent et se tordent.
Nota : Les plus petites gouttes d’eau capables de se
transformer en une glace thermodynamiquement stable ne contiennent
pas plus de 90 molécules ! (chercheurs du CNRS
et de l'ENS-PSL - avec le soutien d'une équipe de l'Ecole
polytechnique, 2019).
- La glace ordinaire.
Si, à la pression atmosphérique normale
(1 atm ou 1013,25 hPa), on abaisse la
température de l’eau liquide en dessous de 0°
Celsius (soit 273,15 K), l’eau se
solidifie : elle se transforme en
glace.
NB:
. la fusion
est l'inverse de la solidification
(solide>liquide), la sublimation est
le passage direct du solide à l'état gazeux
(l'inverse gaz > solide est la sublimation inverse
ou condensation solide).
. la
neige (voir
également ces pages
spéciales) n'est que de l'eau de pluie gelée
(agglomérations de cristaux de glace), et
toute grande masse de glace naturelle provenant de la neige,
permanente à l'échelle humaine forme les
glaciers (pages
internes).
Rappel des états physiques de l'eau en fonction de
Température & Pression :

La structure tétraédrique présente dans
l’eau liquide se fige alors et l’ordre local devient un
ordre à grande distance. Cette glace est donc un solide
cristallin.
Propriétés
de la glace d'eau pure.
Rappel de quelques propriétés :
.jpg)
Nota : l’eau peut donc
exister à l’état liquide en dessous de
0°C à la pression atmosphèrique "normale", cet
état est appelé
surfusion (c'est
un état métastable et la limite de la surfusion est
estimée à –39°C sous 1
atmosphère).
Cet état se produit lorsque l'on refroidit l'eau
rapidement, et l'on alors peut dépasser le point
de congélation (dû à
mécanisme d'obstruction à la formation d'un
réseau
cristallin*),
puis, par apport d'énergie (choc ou
impureté), un dégagement de chaleur va se
produire (libération d'énergie de
334,25 kJ
kg-1.K-1, conditions
TPN) qui fait remonter la
température au voisinage de 0°C et la solidification a
alors lieu :

Ce phénomène prend un certain temps, d'où la surfusion pendant ce délai :

Remarques :
- des scientifiques ont pu atteindre une température de -67.15
°C (206 K) en utilisant un
système à base de matériau nanoporeux de 2.3
nm (MCM-41) , calciné et rendu
hydrophobe par traitement chimique, et une pression de 90 bars
(J. Deschampsab, F. Audonnetac, N. Brodie-Linderad,
M. Schoeffela et C. Alba-Simionescoac),
Physical Chemistry Chemical Physics, 2010, 12,
1440).
- des chercheurs de l'Université de
Frankfort (GOETHE
UNIVERSIÄT, Allemagne, 2018) ont réussi à
porter de l'eau ultra pure à -42.55 °C
(230.6 K) sans qu'elle ne gèle, un record de surfusion
obtenu dans le vide et sans ajout de produits chimique.---
* la théorie voulant que, tout comme le verre reste liquide du fait de l’apparition d’assemblages d’atomes formant des solides platoniciens, il devrait se former dans un liquide en surfusion des structures différentes. On sait en effet que dans le plan et dans l’espace, il est impossible de former des pavages réguliers avec des structures possédant une symétrie d’ordre 5, c'est-à-dire des pentagones dans le plan et des icosaédres dans l’espace (notons tout de même que des pavages quasi-périodiques, comme les célèbres pavages de Penrose sont possibles dans le plan). Un cristal ne peut donc pas exister si des agrégats d'atomes avec des structures de ce type apparaissent dans le liquide. La présence de ces structures pouvait être mise en évidence à l’aide des rayons X produits à l’ESRF et c’est bien ce que les chercheurs ont fait comme ils l’expliquent dans un article de Nature (2014). L'hypothèse que dans d'autres liquides en état de surfusion, le même mécanisme d'obstruction à la formation d'un réseau cristallin est à l'oeuvre en sort donc renforcée.
En règle générale, les
corps sont tous plus denses à l’état solide
qu’à l’état liquide.
Mais il y a deux exceptions connues à cette
règle :
l’eau, et le
Bismuth
(métal, symbole : Bi - Masse atomique : 208,98
- Densité : 9,8 - Fusion : 271,3°C - Ebullition :
1560°C +/-5).
La glace (d'eau pure ou douce) est en effet
moins dense ( plus "légère") que
l’eau liquide : masse volumique : 917 kg m-3 à
0ºC, contre 999,87 kg m-3 à 0ºC pour
l'eau liquide (999,9 kg m-3 pour l'eau
à 4°C).
Rappel : bien qu’il y ait autant de liaisons hydrogène
dans la glace et dans l’eau liquide, dans la glace elles sont
rectilignes alors que dans l’eau liquide elles sont
"tordues" : les distances entre molécules d'eau sont donc
légèrement supérieures dans la glace à ce
qu’elles sont dans l'eau liquide.
Il y a donc plus de "vide" (de lacunes) dans
la glace que dans l’eau liquide et c’est pourquoi la
glace a un volume plus grand, et est de fait moins dense
(NB : l'augmentation de volume est de 9% sous pression atm.
normale).

Cela explique aussi que lorsqu’une bouteille ou une
canalisation pleine d’eau gèle, elle se brise : une
même quantité d’eau occupe un volume plus grand
sous forme de glace qu’à l’état liquide;
ainsi en gelant l’eau se dilate, faisant alors éclater
bouteilles et canalisations (pression > 5
tonnes/cm²).
Nota : calcul de la partie surnageante d'un
iceberg (> voir Hydrostatique
).
Egalement , dans l'équilibre :
|
chaleur + |
|
|
|
en ajoutant de la chaleur à volume constant, la
température augmente et la pression diminue : selon le
Principe de Le Chatelier (voir ces pages
ici),
l'ajout de chaleur à pour effet de déplacer
l'équilibre vers la droite, de l'eau liquide se forme, plus
dense que la glace, et par ailleurs selon le diagramme
d'équilibre des phases de l'eau (courbe solide-liquide),
lorsque la température augmente la pression doit diminuer
:

Une augmentation de pression à température constante, sur l'équilibre glace-eau, déplace celui-ci en faveur de la masse la plus compacte c'est à dire l'eau liquide :

Exemple : en partant du point F situé dans la phase solide
(glace) à pression d'environ 1013 hPa (1 atm) et à
température de -0,1°C constante, si nous montons en
pression, arrivé au point G la glace commence à fondre
(fusion), et au point H la glace est entièrement fondue et
nous arrivons en phase liquide uniquement.
Nota : on remarquera que la pente de la droite solide-liquide est
négative.

Propriétés
(suite).
Sublimation.
Ce phénomène, semblable à l'évaporation
des liquides, se produit lorsqu'un solide passe directement à
l'état de gaz, donc lorsque la glace
(ou la neige) se transforme directement
en vapeur. La sublimation va se réaliser parcequ'un
certain nombre de molécules du cristal de glace ont assez
d'énergie pour s'en détacher, quelque soit la
température. La vitesse de sublimation est faible aux
conditions normales de pression et de température, mais
on peut augmenter le taux de sublimation en abaissant la
pression exercé sur la glace (ou la neige).
La pression de la vapeur en équilibre avec la glace est
appelé pression de sublimation du solide
(ou pression de vapeur à l'équilibre de
la glace) et celle-ci augmente avec la température.

A noter que les pressions (P) et
température (T) limites pour ce
phénomène sont situés au point triple, soit
P = 6,11 hPa (0,06 atm) et T
= 0,01 °C (273,16 K) - (plus exactement :
0,0075 °C).
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
---------------------------------------------------------------------------------------------------
NOTES : le diagramme des phases du dioxyde de carbone
(CO2,
anhydride -ou gaz- carbonique) montre que, contrairement
à l'eau, la droite solide (glace
carbonique) et liquide
(CO2
liquide) présente une pente positive : la glace
de CO2 est plus
dense que le gaz
CO2
liquide.
Nota : Masse volumique de la phase liquide
(à -20 °C et 19,7
bar) : 1032 kg/m3 et Masse volumique du solide
: 1562 kg/m3.


Comme on peut le constater, s'il y a moins de sel (par exemple le
point N), la température atteint est inférieure au
seuil de -22.4°C : le mélange est saturée en
glace. Et s'il y a beaucoup de sel (par exemple le point M), on
obtient une solution saturée en sel et la température
restera au-dessus du minima.



A noter : Rappel de quelques lois de la
cristallographie :
Loi de la constance des angles de Sténon et Romé de
Lisle. « Dans une même espèce cristalline,
l'angle dièdre de faces correspondantes est constant. »
De cette façon, un monocristal croissant formera toujours un
polyèdre convexe limité par des faces planes,
c'est-à-dire que dans des conditions optimales, il ne se
formera jamais aucune forme arrondie dans un cristal, de même
que les faces du cristal sont parallèles 2 à 2 avec
celles du cristal originel.
Loi de stratification multiple d'Haüy. « Un cristal
d'une même espèce est constitué, quel que soit
son faciès, par la juxtaposition de
parallélépipèdes élémentaires,
tous identiques entre eux et caractéristiques de
l'espèce. »
Loi de Curie. « Un corps tend à prendre la forme
qui présente une énergie superficielle minimum
compatible avec les forces d'orientation. Ce minimum d'énergie
potentielle de surface introduit comme solution pour un volume
donné celle qui fournit la surface minimum compatible avec les
liaisons. » Ce principe de minimisation de l'énergie pour
tendre vers une position d'équilibre est universel. Il est
également applicable à la situation des atomes, ions et
molécules au sein même du cristal, en particulier pour
l'énergie réticulaire de cohésion du
cristal.
Pour la glace d'eau, il se forme
autour des germes des cristaux prismatiques hexagonaux. Les cristaux
plus compliqués sont issus de l'évolution de ces
cristaux simples, d'où une symétrie hexagonale. Les
angles du cristal de départ donnent naissance à des
branches. La formation de cristaux dendritiques est alors
favorisée. Le cristal initial de glace est de forme vaguement
sphérique même si sa surface est très
irrégulière à l'échelle
moléculaire. La croissance réduit très
rapidement cette rugosité, les molécules d'eau se
fixant préférentiellement là où elles
peuvent établir le plus de liaisons avec leurs semblables,
donc dans les creux. Petit à petit, la croissance engendre des
plans cristallins. Le cristal est un prisme hexagonal, dont les faces
supérieure et inférieure sont des hexagones (angles de
120 et 60 degrés) et les faces des rectangles.
Trois modes de croissance dominent : les deux premiers sont
commandés par la température. Selon la valeur de
celle-ci, ce sont soit les faces hexagonales, soit les facettes
latérales, qui « poussent » le plus vite. Entre -10
°C et -5 °C, les bases hexagonales se développent
plus : à -6 °C par exemple, cette vitesse de croissance
est le double de celles des facettes latérales et le flocon a
alors l'aspect d'une colonne. Aux températures
supérieures à -5 °C ou inférieures à
-10 °C en revanche, les facettes croissent plus rapidement que
les faces hexagonales : elles poussent par exemple de 0,5
millième de millimètre par seconde à -13
°C, soit quatre fois plus que ne le font les bases. Un flocon de
neige qui reste à cette température pendant toute sa
croissance prend la forme d'une plaquette hexagonale.

....................................(cristal de glace
d'eau - Futura
Scences).........................
Autres formes de glaces.
D’autres formes de glace peuvent être obtenues
à la pression atmosphérique. Par exemple, si l’on
projette de la vapeur d’eau sur une surface refroidie aux
alentours de 77 K (soit –196°C), on
obtient un solide qui ressemble à un liquide figé.
Un tel solide n’est donc pas cristallin : il est dit vitreux ou
amorphe.
(qui n'est pas ordonnée à grande échelle et qui
est donc désordonnée comme un liquide).
Cet amorphe est noté BD (basse densité); en effet il
existe un autre amorphe de plus haute densité. Si l’on
chauffe ensuite cet amorphe BD jusqu’à 150 K
(-123°C), on obtient à nouveau un cristal, mais celui-ci
est de structure cubique, notée
Ic.
Ce n’est qu’à 200 K (-73°C) que l’on
retrouve notre glace habituelle Ih.

Les transformations de la glace sous haute
pression.
Le schéma simplifié ci-dessus se complique
très fortement sous haute pression. Actuellement
(2006), on dénombre plus de 14
formes cristallines de glace haute pression. Ces formes ont
été progressivement découvertes par G. Tammann
à partir de 1900 (solides qu’il a
noté II et III) puis par P.W. Bridgman, de
l’Université d’ Harvard, en 1912 d’abord
(glaces V et VI), puis en 1937
(glace VII).
Contrairement aux deux glaces précédentes, tous ces
cristaux sont plus denses que l’eau liquide correspondante :
à l’équilibre eau-glace, ils chutent au fond des
enceintes haute pression !
Dans la plupart de ces glaces, le désordre des atomes
d’hydrogène est semblable à celui décrit
pour la glace ordinaire Ih. Par contre,
en abaissant leur température, on peut obtenir des solides
haute pression complètement ordonnés, avec des sites
fixes pour les atomes d’hydrogène.
NB : ces informations sont pertinentes pour la recherche spatiale et
pour l’identification éventuelle de l’eau sur
d’autres planètes.
Exemples de diagrammes pression/température
:


D’autres glaces formées sous haute pression peuvent aussi
être détendues à pression atmosphérique,
mais ceci doit toujours être fait à basse
température.
Elles sont alors stables, ce qui permet de les étudier de
manière approfondie à l’aide de diverses
méthodes comme la diffraction X et la diffraction de
neutrons.
Enfin, en comprimant très fortement la glace Ih (ou
VI), on peut atteindre la situation où la distance
oxygène-oxygène entre deux molécules d’eau
voisines est approximativement égale à deux fois la
longueur de la liaison de valence oxygène-hydrogène au
sein d’une molécule d’eau. L’hydrogène
est alors également partagé entre les oxygènes
de deux molécules voisines. Cette situation commence à
apparaître vers 60 GPa (60 000 Mpa), et
elle est bien caractérisée vers 100 GPa
(100 000 Mpa ou 1 000 000 bars).
Dans ce cas, on n’a plus de molécules
H2O. Le solide est devenu un oxyde
d’hydrogène, au même titre que Cu2O est
un oxyde de cuivre. On a atteint la glace notée X dite
symétrique, dont la structure, est dite (justement)
cuprite.
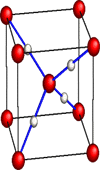
Configuration de la glace X obtenue par compression de
la glace Ih (ou VI) vers 100 GPa.
[Structure cuprite Cu2O]
:
---------------------------
Dernières nouvelles du front glacé ! :
Depuis 1984, les physiciens avaient ainsi répertorié
une douzaine de phases cristallines de la glace différentes.
Une équipe canadienne avait observé, cette
année-là, un comportement étrange de la glace.
À une température très basse (–196°C)
et à une pression plus de 10 000 fois supérieure
à celle de l'atmosphère, elle peut se transformer en
une curieuse substance dans laquelle les molécules ne sont
plus ordonnées comme dans un cristal mais disposées au
hasard (dans le langage ordinaire, le mot hasard est
utilisé pour exprimer un manque apparent, sinon de causes, au
moins de...) comme dans un verre ou un liquide !
Comment ce "verre d'eau" a-t-il pu être créé ?
C'est à ce mystère vieux de vingt ans qu'ont voulu
répondre Stefan Klotz et ses collègues. En
étudiant, à l'aide d'une technique dite "de diffusion
inélastique des neutrons" (à une
température de – 130 °C et une pression 5 000 fois
supérieure à celle de l'atmosphère), le
passage de l'état "cristallin" à l'état
"amorphe", ces physiciens ont établi qu'au
niveau moléculaire, cette transformation ne pouvait être
assimilée à une sorte de "fusion à froid", comme
celle en jeu lorsque, par exemple, la glace devient liquide
(en physique et en métallurgie, la fusion est
le passage d'un corps de l'état solide vers l'état
liquide).
Selon ces chercheurs, si la glace devient un solide amorphe, c'est
qu'à ces températures et à ces pressions
extrêmes, le cristal est "mécaniquement" instable et
s'effondre sur lui-même, non sous l'effet de l'agitation
moléculaire mais par l'écroulement des forces
élastiques assurant sa cohésion. Ne pouvant plus se
réorganiser en un nouveau type de cristal, l'eau n'aurait
alors plus le choix que de se "figer" en l'état à la
manière d'un verre. Faute de mieux, en quelque sorte...
En 2006, dans un laboratoire de l'université d'Oxford (GB),
l'équipe de Christophe Salzmann (P. G.
Radaelli, A. Hallbrucker, E. Mayer and J. L. Finney) a
découvert deux nouvelles formes de glaces cristallisées
: XIII et XIV. Obtenues à -143 et -155°C, P
= 0,5 et 1,2 GPa, et avec un acide (HCl) servant
d'accélérateur-catalyseur du processus de
cristallisation.
En 2014, des chercheurs ayant utilisé les faisceaux de
neutrons disponibles à l’Institut Laue-Langevin (ILL) ont
de publié dans Nature, les résultats de leurs
travaux sur un nouveau type qui est la moins dense de toutes les
formes de glaces connues. Il s’agit de la glace XVI. Les
chercheurs ont de bonnes raisons de penser que la structure de la
glace XVI est représentative de celle des clathrates
(du grec klathron qui signifie fermeture).
L’intérêt de ces travaux vient donc de ce
qu’il concerne directement les propriétés des
clathrates à base de molécules d’eau. Il
s’agit de composés possédant une structure
cristalline et formant des sortes de cages moléculaires
enfermant d’autres molécules ou des atomes. Son
étude a donc le potentiel de livrer certains secrets de la
physique et de la chimie des clathrates précieux aussi bien
pour protéger la planète que pour les exploiter comme
source d’énergie. Mais encore fallait-il créer
cette glace qui s’apparente à ce que l’on peut
appeler un clathrate vide. Pour ce faire, les physiciens et les
chimistes en ont synthétisé rempli de molécules
de néon (formées de petits atomes,
elles permettent de vider le clathrate sans compromettre sa fragile
structure), qu’ils ont ensuite extrait en plaçant
le clathrate dans un vide à une température avoisinant
140 K. Les faisceaux de neutrons disponibles à l’ILL ont
été diffractés par le matériau au cours
de sa formation, ce qui a permis de s’assurer que l’on
obtenait bien un clathrate et de recueillir des renseignements sur sa
structure.
Le clathrate le plus connu est l’hydrate de
méthane. Il défraye régulièrement
la chronique, car ceux qui sont présents dans le permafrost et
dans de vastes couches sédimentaires à des centaines de
mètres au fond des océans sont potentiellement
instables et risque de libérer d’immense quantité
de méthane (lien
interne sur ce gaz) dans l’atmosphère à
cause du réchauffement climatique. Or ce gaz qui constitue
aussi une source d’énergie est un gaz à effet de
serre particulièrement puissant. On étudie donc les
gisements naturels considérables d’hydrate de
méthane pour deux raisons contradictoires :
Selon Thomas Hansen, l’un des chercheurs impliqué dans
les travaux sur la glace glace XVI : « Il faut savoir que
l’on peut aussi former des clathrates avec du dioxyde de
carbone, qui est stable dans les conditions des fonds
océaniques. Cela signifie qu’il existe une
possibilité d’extraire le méthane de son hydrate
pour le transformer en énergie utile, en le remplaçant
par le CO2. Autrement dit, on pourrait envoyer le CO2 au fond des
océans pour prendre la place du méthane dans les
clathrates. Un défi de taille, certes, et dont la
faisabilité pose question, mais cela reste une
possibilité fascinante qui vaut la peine d’être
approfondie ».
En 2019, les chercheurs nous annoncent que grâce aux
progrès de la technologie, notamment des lasers, il a
été possible de vérifier l'existence d'une toute
nouvelle phase de la glace prédite depuis 1988 grâce
à des simulations numériques de dynamique
moléculaire basées sur les équations de la
mécanique quantique. Ce genre de simulation du comportement
d'un grand nombre de molécules en interaction permet de faire
des expériences virtuelles pour étudier le comportement
de la matière dans des conditions qui sont difficiles voire
impossibles à réaliser en laboratoire, ce qui est
typiquement le cas des très hautes pressions.
En l'occurrence, ces simulations prédisaient même ce que
l'on pourrait appeler un nouvel état de la matière,
même si les termes de glace XVIII ou de glace
superionique sont utilisés pour le désigner. Ainsi,
notamment à des pressions de l'ordre de 100 à 400
gigapascals (1 à 4 millions de fois la
pression atmosphérique de la Terre) et à des
températures de 1.650 à 2.760 °C, l'eau liquide
devait se changer en une structure où les atomes
d'oxygène des molécules d'eau initiales occupent les
sites d'une structure cristalline cubique, alors que des protons des
atomes d'hydrogène pouvaient se déplacer comme les
atomes d'un liquide à travers ce solide. Cette glace
superionique devenait donc conductrice
d'électricité.
Un article de Nature vient de clore le débat en montrant que
la glace XVIII existe bel et bien. Les physiciens l'ont obtenue en
comprimant de l'eau liquide entre deux diamants à l'aide
d'ondes de choc produites par l'irradiation de ces diamants à
l'aide de faisceaux laser. La technique est similaire à celle
employée pour faire des expériences sur la fusion
inertielle. En vaporisant la surface des diamants, on
déclenche la libération d'un gaz de particules
provoquant le mouvement des diamants dans la direction opposée
en raison de la conservation de la quantité de mouvement. Une
autre série de faisceaux laser est utilisée
parallèlement pour vaporiser une lamelle de fer qui conduit
à la formation d'un plasma émetteur de rayons X. Ces
rayons X à leur tour sont diffractés par leur passage
à travers la glace XVIII ce qui permet d'obtenir une tache de
diffraction analysable selon les méthodes bien connues de la
cristallographie avec des rayons X.
En 2022, des chercheurs (Université du Nevada à Las
Vegas, États-Unis) ont placé un échantillon
d'eau au cœur d'une cellule à enclumes de diamant. L'eau
a ainsi été pressée par à-coup
jusqu'à des pressions comme celles qui règnent au
centre de notre Terre. Par à-coup parce que les physiciens ont
régulièrement mis le processus en pause pour
réchauffer l'ensemble au laser. Ainsi, l'eau a gelé,
puis les cristaux de glace ont fondu. Et il s'avère que
l'opération a mené à la formation d'une
variété d'arrangements des atomes d'oxygène (O)
et d'hydrogène (H) qui composent l'eau. Les chercheurs ont
observé d'abord la formation d'un type de glace connue, la
glace VII, de structure cubique, mais aussi de glace X, ils s'y
attendaient, mais à des pressions bien plus
élevées -- de l'ordre du million d'atmosphères
(contre « seulement » 300.000 ici). Et enfin, entre les
deux, une forme glace de transition baptisée VIIt avec une
structure tétragonale !
Nota : les astrophysiciens, en particulier, sont
intéressés par ces nouveaux résultats
démontrant l'existence de la glace superionique. Ils savent en
effet que la majeure partie de l'eau dans le Système solaire
doit se trouver sous forme de glace à l'intérieur des
géantes que sont Uranus et Neptune.
D'importantes couches de glace solide mais néanmoins chaude
devraient se trouver aussi dans les profondeurs des planètes
océans. Chaude, quatre fois plus dense que la glace ordinaire,
noire et conductrice de l'électricité comme le ferait
un métal où le fluide d'électrons aurait
été remplacé par un fluide de protons, la glace
XVIII pourrait donc être la glace extraterrestre la plus
répandue dans le royaume des exoplanètes.
On peut s'attendre à quelques surprises car la glace à
l'intérieur de Neptune et Uranus n'est pas faite uniquement de
molécules de H2O. Des molécules de méthane et
d'ammoniac sont aussi présentes et il va falloir
étudier la question de la formation d'une glace superionique
avec elles...
Sources et liens :
- Futura
Sciences - Planète,
- CNRS / Philippe PRUZAN (Laboratoire de physique des
milieux condensés, Université Paris VI,
lien),
et lien
sur les structures eau/glace (en anglais)
- Généralités sur les Glaciers (pages
internes, et UJF-Grenoble, lien)
- Physical Review Letters, 26 novembre 2004
|
|