Graphique de Pression de vapeur en fonction de la température :
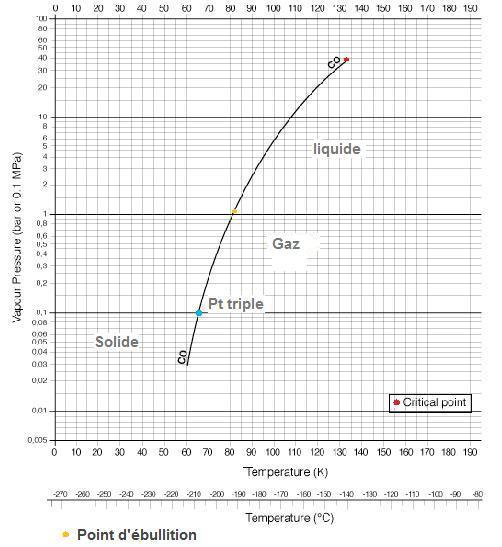
(rappel : 1 bar = 1000 hPa = 0,1 MPa)
----------------------------
GENERALITES :
Le monoxyde de carbone est le résultat de la combinaison
de deux éléments : un atome de carbone C et un
atome d'oxygène O, soit CO.
Masse molaire 28,01 g mol-1.
Il est à l'état gazeux dans les conditions normales de
pression et de température.
Masse volumique Mv de la phase gazeuse (1013,25 hPa,
et 15 °C) : 1,184 kg m3-1
(donc légérement plus léger que l'air - Mv
= 1,225 kg m3-1
[à 1013,25 hPa, et 15
°C]).
Le monoxyde de carbone (inodore) est très toxique pour les
mammiferes. Il est la cause d’intoxications domestiques
extrêmement fréquentes, parfois mortelles en cas
d'absence de détection ou de survenue brutale dans l'air
respirable de l'homme.
Son émanation provient fréquemment d'un chauffage
déréglé. Le mélange avec l’air est
aisé puisque sa densité est proche de celle de
l’air.
Le CO est émis par les automobiles quand la température
est insuffisante pour une oxydation complète des hydrocarbures
de l'essence en eau et en CO2; température
insuffisante du fait d'une durée insuffisante dans la chambre
de combustion ou du fait d'une présence insuffisante
d'oxygène. La première source de CO pour l'homme est la
cigarette.
Propriétés.
Le CO gazeux est incolore et inodore à température et
pression normales, très peu soluble dans l'eau.
L'équilibre de Boudouard correspond à la
réduction du dioxyde de carbone CO2 par le carbone
solide C, en monoxyde de carbone gazeux CO :
La variation d'enthalpie standard de cette réaction
à 25 °C (298 K) vaut DH°
= 172,3 kJ mol-1.
Cette réaction est endothermique, elle est donc
favorisée par une augmentation de la température.
D'autre part, une baisse de pression favorise également cet
équilibre. Cet équilibre intervient par exemple dans
l'effet de serre ou lors des réactions de
carboréduction.

Le point triple (
Température = -205,1 °C (68,05 K)
et Pression : 153,5 hPa [0,1535 bar] ) est inférieur
à la pression "normale" de 1013,25 hPa (1,013
bar), ainsi donc le CO liquide peut exister à
cette pression mais à des températures très
basses (<192°C).
Le Point Critique se situe
à Pc = 3,4987 MPa ( 34,987 bar ) et Tc
= -140,3 °C [132,85
K] .
Le monoxyde de carbone est un combustible. La réaction
de combustion complète du C2H6
s'écrit :
1 m³ (1,184 kg) de monoxyde de carbone
à 15 °C libère une énergie de 11,94 MJ
(3,31 kWh).
Variation d'enthalpie libre DH° =
-282,52 kJ/mol.
Température d'auto-inflammation : 630 °C
(903 K)
Applications.
Industrie chimique
En augmentant la pression au delà de 100 atm et en
adaptant la catalyse, la synthèse de combustibles liquides,
sous forme d'hydrocarbures, ou encore d'alcènes, d'alcools, de
glycols ou de cétones est réalisable. Par exemple la
synthèse du méthanol CH3OH.
Production d'acide acétique
(CH3COOH) en faisant réagir CO et du
méthanol en présence de rhodium
comme catalyseur (procédé
Monsanto)
L'addition du CO sous forme de gaz de synthèse avec les
alcènes, appelée réaction OXO, permet la
synthèse industrielle de composés organiques communs,
tels que par exemple les isocyanates, l'acide formique, et aussi
certains polymères tels que les polycarbonates et les
polycétones.
Avec le nickel Ni et le fer Fe, comme avec les autres métaux
de transition du groupe VI, VII et VIII, le monoxyde de carbone peut
former des composés d'addition (métaux carbonyles).
Laboratoires et analyses.
Le monoxyde de carbone est utilisé pour calibrer les
analyseurs d'impuretés en trace, les analyseurs de
contrôle de l'environnement , les analyseurs de contrôle
des atmosphères de travail ou des procédés en
pétrochimie.
MODE D'APPROVISIONNEMENT :
Le monoxyde de carbone peut être distribué :
Risques :
Ce gaz est un poison pour les vertébrés : il a une
forte affinité (230 fois supérieure
à celle du dioxygène) pour l'ion fer de
l'hémoglobine, le principal transporteur d'oxygène dans
le sang. De ce fait, peu de CO dans l'air inspiré conduit
rapidement à la formation de carboxyhémoglobine qui
remplace l'oxyhémoglobine. La capacité de transport de
l'oxygène est diminuée et devient rapidement
insuffisante pour apporter l'oxygène nécessaire aux
tissus. Par ailleurs, le CO bloque des enzymes de la chaîne
respiratoire mitochondriale : il s'ensuit une impossibilité
pour la cellule d'utiliser l'oxygène qui lui parvient. Ainsi,
l'organisme souffre rapidement d'une hypoxie
généralisée : hypoxie "de transport"
(dite hypoxie hypoxémique) et hypoxie
"d'utilisation" (dite hypoxie
histotoxique).
Les tissus les plus sensibles au manque d'oxygène sont ceux
qui en utilisent le plus, surtout si leur réserve
énergétique est faible : le système nerveux
central et le cœur sont les plus touchés. Une exposition
suffisante peut rendre une personne inconsciente simplement en
réduisant l'apport d'oxygène au cerveau, et provoquer
des dommages cérébraux jusqu'au décès par
anoxie. La carboxyhémoglobine a une teinte rouge vif de tel
sorte qu'un empoisonnement au CO peut provoquer une teinte rose au
niveau des joues. Cette coloration dite "teinte cochenille" est
rarement observée en clinique. Elle est parfois
constatée dans les intoxications massives, lors d'une
autopsie.
Nota : l'intoxication au monoxyde de carbone est la première
cause de décès par intoxication en France.
Risques majeurs.
Lien
(ministère français de la Santé) sur les effets
du CO.
Fiche de
Sécurité : fichier
pdf à télécharger éventuellement (27
ko).
 - Retour
: veuillez utiliser celui de votre navigateur, par
exemple >
- Retour
: veuillez utiliser celui de votre navigateur, par
exemple >