Diagramme des phases
GÉNÉRALITÉS
:
Le Néon est un des gaz de l'air
atmosphèrique (voir ce
lien sur l'air). Il
représente 0,0018 % (18 ppm) du volume
total de l'atmosphère terrestre. Il appartient au groupe des
gaz "rares" (parfois appelé "gaz
nobles"), avec l'argon, l’hélium, le krypton et le
xénon.
De formule Ne, c'est un gaz inerte et incolore comme le
di-azote N2, à l'état naturel il n'est
présent que dans l'air.
Masse atomique : 20,179
g mol-1
(numéro atomique Z = 10).
Isotopes : stables > 20Ne,
21Ne et 22Ne.
Propriétés du Néon
Le néon est un un gaz incolore, inodore, inerte et
ininflammable.
Il donne une lueur rougeâtre distinctive lorsqu'il est
utilisé dans les tubes à vide et les "lampes
néon".
À des tensions et des courants normaux, le néon a la
décharge la plus intense de tous les gaz rares.
Nota : c'est par une généralisation abusive qu'on
dénomme "néons" tous les tubes fluorescents, et
notamment ceux des enseignes lumineuses. Seul le rouge est en effet
possible avec le néon, et les autres couleurs sont, soit
obtenues avec d'autres composés : hélium>jaune,
CO2 > blanc, argon > violet, argon/mercure >
bleu. Soit produites par un revêtement fluorescent
excité par un rayonnement ultraviolet.
Il est largement utilisé dans certaines applications
industrielles, car c'est un
réfrigérant moins cher que
l'hélium, et il possède 40 fois sa capacité
cryogénique.
Le néon est en principe le moins réactif de tous les
gaz nobles, et on considère généralement qu'il
est pratiquement inerte chimiquement. Les énergies de liaisons
calculées pour le néon avec divers
éléments (hydrogène, bore,
béryllium, métaux nobles) sont encore
inférieures à celles calculées pour
l'hélium.
Aucun composé neutre du néon n'a été
identifié, en revanche les ions moléculaires
HNe+, HeNe+, Ne2+ et
NeAr+ ont été observés lors
d'études optiques ou spectroscopiques
Aux conditions "normales" de pression (1013,25
hPa), c'est un gaz plus léger que l'air : 0,853
kg/m3 à 15 °C et 0,8999 kg/m3
à 0°C.
Solubilité dans l'eau (à 1,013 bar et 0
°C) : 0,014 vol/vol (14 ml dans 1 litre
d'eau), donc moins soluble que l'azote
N2 (23,4 ml/L), l'oxygène
O2 (48,9 ml/L) ou l'argon
(53,7 ml/L).
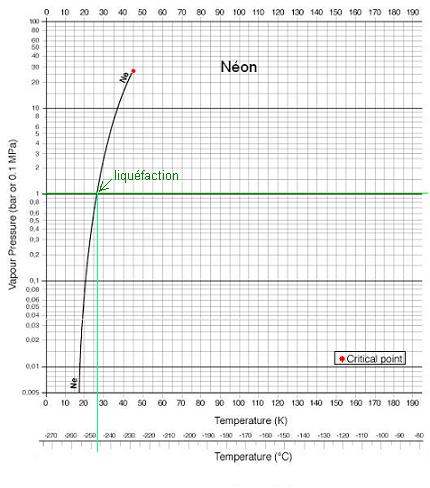
Il se liquéfie vers -246°C
(27,15 K) sous 1,013 bar (1
atm).
Le point d'ébullition du néon
liquide se situe vers -246,1 °C (27,05
K).
Le point de fusion du néon solide
(néon congelé) est à -249
°C (24,15 K) sous 1 atmosphère, et
c'est donc aussi le point approché, de solidification du
néon liquide.
Le Point Triple se situe vers T =
-248,6 °C (24,55
K) et Pression = 4,34·10-8 hPa, il se trouve
donc largement inférieur à la pression
atmosphérique "normale" (1013,25 hPa ou 1,013
bar), et le néon liquide
et solide ne peuvent ainsi exister aux pressions et
températures "classiques" sur Terre.
Point Critiques : Pression Pc = 2,756
MPa (27,56 bar) et Température Tc =
-228,8 °C [44,35
K].

Quelques caractéristiques :
Utilisations.
Divers.
- Recherche sur les particules ionisées.
- Refroidissement des détecteurs infra-rouges ultra sensibles.
- Détection de particules ionisées dans les chambres à bulles.
Effet sur l'homme.
Risque de suffocation : une inhalation d’une grande
quantité comporte des risques d’asphyxie par privation
d’oxygène.
Lien
(canadien) sur les dangers des liquides cryogéniques.
A noter que les atmosphères des autres planètes
télluriques Vénus et Mars contiennent respectivement 7
ppm (0,0007%) et 2,5 ppm
(0,00025%) de gaz Néon.