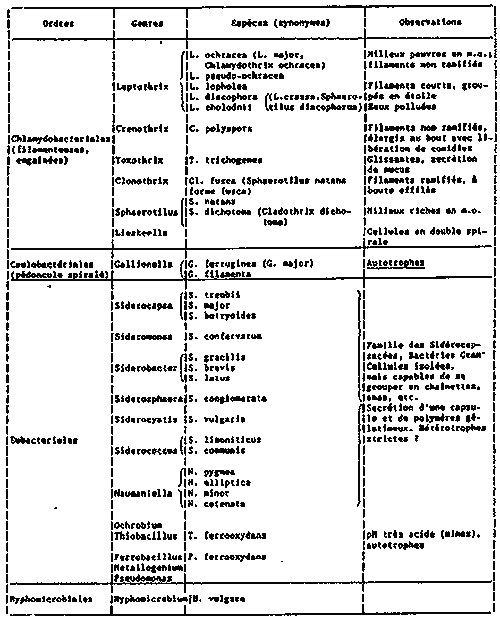
Voir ci-joint un tableau de certaines
bactéries intervenant dans l'oxydation du fer :
(sources : P.Mouchet, TSM n°401, juillet/aout 1989)

Comme le souligne
P.Mouchet, la classification des ferrobactéries a
été sujette à de nombreuses controverses et
modifications [par ex. ; WINOGRADSKY,
1888 ; STAR-KEY, 1945 ; PRINGSHEIM, 1949 ; STOKES, 1954 ;
HÔHNL, 1955 ; MULDER & VAN VEEN, 1963 ; MULDER, 1964 ;
PETITPREZ & LECLERC, 1969 ; HANERT, 1981a et 1981b]
> elle est
donc peut-être susceptible d'évoluer encore à
l'avenir.
Les bactéries du fer
(et du manganèse) sont très répandues dans la
nature, non seulement dans les eaux souterraines, les puits, les
stations de traitement d'eau, les tuyauterie d'eau brute ou d'eau
traitée, mais également dans les sources, les
étangs, sur les sédiments des lacs, etc ...
L'ensemencement naturel des installation de traitement pose donc, en
général, et surtout dans le cas du fer, peu de
problèmes.
Leurs conditions de croissance sont essentiellement :
- la température
- le pH
- l'oxygène dissous
- le potentiel Redox
- le rH (il s'agit d'une fonction combinée du pH et du potentiel Redox)
- la concentration en fer et en manganèse
- la salinité
- la teneur en matière organique.
Les risques de limitation des bactéries du fer seront très rares dans les eaux naturelles. La seule condition impérative est de les placer dans des conditions de pH et de potentiel redox (c'est-à-dire de rH) correspondant à leur domaine d'activité. Ceci est illustré dans le tableau suivant :
|
|
|
|
|
|
|
|
|
|
|
|

Modes d'action des
bactéries du fer.
La déferrisation biologique, dans son principe, ne
diffère pas fondamentalement des procédés
d'oxydation (à l'air) et de filtration. Il s'agit d'un
phénomène de nature catalytique, qui induit une
oxydation du fer permettant de combiner les phases d'oxydation et de
filtration dans un seul appareil, même si le pH est
inférieur à 7.
Ainsi, de nombreuses bactéries permettent, en milieu
aérobie une oxydation biologique du fer. Pour certaines
bactéries, l'oxydation de ce métal est indirecte : elle
est due à l'augmentation du pH liée à la
croissance de ces bactéries. Cette augmentation du pH au
voisinage de la bactérie permet l'oxydation du fer par
l'oxygène à une vitesse variable.
On notera que pour les métaux complexés aux
matières organiques, diverses bactéries
hétérotrophes utiliseraient la fraction organique des
complexes fer/matière organiques, ce qui libérerait le
fer et permettrait sa précipitation par voie catalytique au
voisinage de leurs capsules. Ce retour des métaux à
l'état minéral pourrait permettre à des
bactéries autotrophes de prendre le relais pour leur oxydation
et leur précipitation.
Limites pratiques du procédé.
Dans les conditions standards (décrites plus loin), on
peut traiter des eaux ne présentant pas d'autres nuisances que
fer et dont les teneurs de certains éléments ne peuvent
généralement pas dépasser des valeurs limites
données ici :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

REMARQUES SUR CE DERNIER POINT :
II peut arriver que la déferrisation biologique soit
envisageable, en dehors des limites susnommées : lorsqu'une
partie importante du fer est complexé, des teneurs en
O2 dissous supérieures aux valeurs exprimées
par la courbe peuvent tout à fait être envisagés,
dans la mesure ou ce fer complexé ne pourra pas s'oxyder
chimiquement à l'air (par des quantités d'air
standard). Des cas de figures existent ou les quantités
d'oxygène sont de 2 à 8 fois plus importantes que
prévu.
A l'inverse, le procédé doit encore être
simplifié (par suppression de l'injection d'air) lorsque les
coordonnées pH/oxygène dissous de l'eau brute
définissent un point situé sur ou au voisinage de la
courbe.
Conditions non standards :
Les conditions non standards s'appliquent aux eaux dont certains
éléments présents entraînent une
modification légère du procédé, mais qui
peuvent cependant être traitées par un système
biologique. Ce cas est celui ou la présence de
manganèse est supérieure à 0,05 mg/l ou l'
hydrogène sulfuré (H2S) est
soupçonnée.
Chaque cas devrait être étudié
spécifiquement
PROCEDE BIOLOGIQUE :
Cette filière comportera simplement un filtre à
sable et :

REMARQUES - Compacité des
installations biologiques :
Ceci est illustré, pour une installation de 100 m3/h, par la
figure suivante.

Avantages de la déferrisation biologique.
Le fer est retenu sous forme très compacte. Il en résulte une capacité de rétention du fer (entre 2 lavages) très élevée. Comme pour la déferrisation par voie physico-chimique, cette capacité est fonction de la teneur initiale en fer de l'eau brute, mais est plus importante que dans le cas de la déferrisation physico-chimique. Il en résulte une économie appréciable sur la dépense en eau de lavage.
» Vitesse de filtration élevée :
Grâce à la nature du floc, les vitesses de
filtration sont en général 2,5 à 5 fois plus
importantes.
» Augmentation de la taille effective du sable :
Les fortes vitesses de filtration sont favorisées par
la possibilité de choisir un sable plus gros, grâce
à la nature des précipités formés et
à la morphologie des bactéries. En pratique, on peut
choisir un sable de taille effective de 1,30 mm ou même
davantage. Ce qui induit que la perte de charge dans le
matériau reste pratiquement identique, malgré
l'augmentation de vitesse.
» Amélioration de fonctionnement d'anciennes
installations :
Selon les cas, on peut procéder à la
rénovation d'usine en adoptant une ou plusieurs des
mesures suivantes :
- changement des conditions d'aération,
- changement du milieu filtrant,
- suppression des réactifs, en particulier les oxydants forts,
- modification du pH,
- pré-chloration reportée en post-traitement.
Pour finir, par
sécurité, et afin de s'assurer de la faisabilité
de la déferrisation biologique, il est souvent
préférable de procéder à un essai
pilote sur le site. Quinze jours d'essais sont suffisants pour
vérifier si le procédé fonctionne
correctement.
Variantes.
Présence de micropolluants : utilisation de bicouche
(charbon-sable) pour la filtration.
Turbidité > 1 NTU : mise en oeuvre d'une
coagulation/floculation directe sur sable ou bicouche.
Manganèse : lorsque l'eau contient
simultanément du fer et du manganèse (> 0,5 mg/l) on
est obligé d'observer des conditions de rH différentes
pour l'oxydation de ces deux éléments par voie
biologique. En outre, l'élimination du manganèse ne
commencera que lorsque celle du fer sera terminée. On pourra
donc adopter le schéma suivant :
- première aération réglée par la déferrisation biologique,
- première filtration : déferrisation biologique,
- deuxième aération et/ou relèvement du pH,
- deuxième filtration : démanganisation physico-chimique avec oxydant complémentaire,
ou démanganisation biologique.
La présence simultanée de fer et de
manganèse limite donc à priori
l'intérêt de traiter biologiquement ces deux
éléments (étude nécessaire).
Ammoniaque : il ne
perturbe pas sensiblement les processus biologiques de
déferrisation et/ou de démanganisation. Ce
paramètre n'est donc pas limitatif. Son oxydation par le
chlore en amont du réacteur biologique n'étant pas
envisageable, celle-ci devra être réalisée en
aval. Un temps de contact minimum de 30 minutes (selon certains
auteurs 1h) est à prévoir pour assurer cette oxydation.
Les conditions de pilotage de l'injection de chlore devront
être étudiées avec un soin tout particulier.
Ozone en post-traitement. :
lorsque la filière prévoit une
désinfection par l'ozone en phase finale du traitement, la
filière biologique est à éviter en
présence de manganèse. Il apparaît en effet
difficile de maintenir par ce procédé un
résiduel en manganèse dans l'eau traitée
inférieur à 20 µg/l.
Le dépassement de ce seuil peut générer,
après oxydation par l'ozone, une coloration rosé de
l'eau distribuée (à vérifier par des tests).
Divers.
Utilisation d'eau traitée
(pour les lavages) : de l'eau traitée sera
prélevée avant l'injection de chlore (ou
d'ozone) ou déchlorée (injection d'hyposulfite sur le
refoulement de la pompe de lavage).
Neutralisation des oxydants de l'eau de lavage (si
Cl2 > 0,3 ppm) :
Les réactifs à utiliser peuvent être, soit
l'hyposulfite de sodium, soit le bisulfite de sodium ; les taux de
traitement en produit pur à mettre en oeuvre sont
stochiométriquement de :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CONCLUSIONS GENERALES
La déferrisation biologique est le traitement de choix des
eaux à pH acide, neutre ou très faiblement alcalin,
riches en fer et éventuellement en silice, mais
dépourvues d'acides humiques et d'éléments
toxiques tels que H2S (qui peut toutefois être
éliminé par une aération ouverte), métaux
lourds (par exemple, inhibition au-dessus de 0,1 à 0,2 mg/l de
zinc), certains micropolluants organiques, etc.

(sources : plaquette CGE/OTV)
|
|
|
|
|
Leptothrix (L. cholodnii L.
discophora L. lopholea L. ochracea) |
|
|
Metallogenium (M. personatum
M. symbioticum) |
|
|
Hyphomicrobium (H. vulgare) |
|
|
Streptomyces sp., Nocardia sp. |
On constate qu'à l'exception
des bactéries pédonculées ou
Caulobactériales (du genre Gallionella) qui n'oxydent que le
fer, et de quelques espèces généralement
réputées hétérotrophes, on y retrouve les
grands groupes que nous avons déjà vus à propos
des ferrobactéries ; certaines espèces, appartenant aux
genres Leptothrix, Hyphomicrobium, Siderocapsa, Siderocystis,
etc.
Elles sont même capables d'oxyder indifféremment le fer
ou le manganèse, mais dans des conditions de milieu
différentes.
Lorsque ces conditions sont favorables, toutes ces bactéries
sont capables de provoquer ou d'accélérer, en milieu
aérobie, une oxydation du manganèse par
l'oxygène dissous.
Pour certaines de ces bactéries, l'oxydation de l'ion
Mn2+ serait indirecte, grâce à l'augmentation
de pH liée à leur croissance : les conditions alcalines
ainsi créées au voisinage immédiat de la
bactérie permettent en fait que l'oxydation chimique du
manganèse soit suffisamment rapide.
Toutefois, la plupart du temps il s'agit d'un processus
biocatalytique pouvant se dérouler, comme dans le cas des
bactéries du fer, suivant diverses modalités
:
La finalité des
différents phénomènes peut correspondre à
divers objectifs ; on peut penser en premier lieu, comme dans le cas
du fer, à la fourniture d'énergie pour les organismes
autotrophes ; toutefois, l'autotrophie stricte sera encore moins
courante chez les bactéries du manganèse que chez
celles du fer, car l'oxydation du manganèse divalent sous ses
diverses formes fournit encore moins d'énergie que celle du
fer (2 à 6 fois moins, suivant les cas).
Les bactéries du manganèse sont donc, en
général, exclusivement ou partiellement
hétérotrophes (sans toutefois qu'il soit
nécessaire d'introduire un aliment carboné dans l'eau
brute, contrairement aux traitements de dénitrification, car
l'action catalytique s'exerce ici grâce à des enzymes ou
des polymères sécrétés par une biomasse
relativement très faible) ; les hypothèses
émises sur la finalité de l'oxydation et la
précipitation du manganèse se sont alors
orientées sur des actions de détoxication du milieu,
suivant le cas :
Dans tous les cas, le
manganèse se dépose sous forme de dioxyde, anhydre
MnO2 ou hydraté MnO(OH)2 ; il forme des
précipités noirs très compacts, amas entourant
les cellules bactériennes ou pustules garnissant les gaines
des bactéries. Comme dans le cas de la déferrisation,
les précipités de manganèse obtenus par voie
biologique sont beaucoup mieux structurés que ceux qui
résultent de réactions purement chimiques, probablement
parce que la précipitation du MnO2 se produit
à l'intérieur d'une matrice de polymères
extracellulaires (sources : P.Mouchet, juin 1994).
Conditions de croissance bactérienne :
Nota : les conditions aérobies sont plus impératives
que dans les cas de la déferrisation.
- Teneur en oxygène dissous de l'ordre de 50 à 90 % de la saturation;
- Potentiel d'oxydo-réduction supérieur à 300 mV environ;
- rH supérieur à une valeur de l'ordre de 25;
- pH supérieur à 7,5.
Si l'on compare ces dernières
valeurs à celles qui caractérisaient le champ d'action
des ferrobactéries, on voit que les deux domaines se
juxtaposent, en se recouvrant très peu : la conception de base
d'une installation de démanganisation biologique sera donc peu
différente de celle d'une déferrisation biologique, et
l'on pourra difficilement obtenir l'élimination
simultanée des deux éléments dans le même
filtre biologique.
Traitement
standard.
(eau ne contenant que du
manganèse)
Comme dans le cas de la déferrisation biologique, la
démanganisation biologique peut être
réalisée dans des stationsgravitaires ou sous
pression, comprenant une aération et une filtration. La
seule différence avec la catégorie
précédente réside dans l'aération, qui
doit être toujours intensive du fait des exigences du
procédé en matière d'O2 dissous (une
aération complémentaire de l'eau filtrée
s'avère donc généralement inutile).
Stations sous pression:
C'est la solution la plus fréquemment adoptée, du moins
en France ou les débits correspondant à ce traitement
sont rarement élevés. Le schéma-type d'une telle
station est tout à fait semblable à celui d'une station
de déferrisation biologique avec les différences
suivantes :
- seule subsiste l'aération amont (en ligne avec pot mélangeur), le débit d'air étant calculé sur les mêmes bases que pour une déferrisation physico-chimique ; il n y a donc jamais d'aération ménagée dans ce cas;- un produit d'ajustement du pH (chaux, soude, Na2CO3,...) peut être introduit en amont de la filtration;
Stations gravitaires:
Aération intensive + filtres gravitaires
(métalliques ou en béton),
Cette méthode peut être envisagée :
Paramètres de
fonctionnement.
Vitesse de filtration :
Comme dans le cas de la déferrisation biologique, les
boues sont très compactes A ce facteur s'ajoute à la
rapidité des phénomènes d'oxydation pour
permettre des vitesses de passage très élevées,
lesquelles sont toutefois, comme en déferrisation, fonction de
la teneur en manganèse à éliminer : la gamme
habituelle est de 10 à 30 m/h.
Milieu filtrant:
Ensemencement
:
(naturel ou provoqué)
Le développement des bactéries est beaucoup plus lent
qu'en déferrisation biologique : le temps de démarrage
d'une station sur sable neuf est, dans ce cas,
généralement compris entre 0,5 et 2 mois, voire
davantage. Il faut souvent :
- 1 à 2 semaines pour amorcer un début de démanganisation,
- près de 1,5 mois pour que le traitement atteigne sa pleine efficacité.
dans des cas semblables, un suivi
quotidien du potentiel d'oxydo-réduction (Eh) dans l'eau brute
et dans l'eau traitée permet de confirmer l'évolution
favorable du démarrage de la station.
Le départ d'une démanganisation biologique peut
être facilité si le milieu filtrant contient du
MnO2, par exemple s'il s'agit d'un sable naturellement ou
artificiellement enrobé de MnO2 : il se produirait
alors une adsorption de Mn2+ sur MnO2, suivie
d'une oxydation catalytique et d'une oxydation bactérienne
simultanées, phénomènes qui ont
été désignés sous l'appellation globale
de "bioadsorption" (P.Mouchet, 1994).
On peut aussi raccourcir le temps de maturation en ensemençant
le filtre avec des boues provenant du lavage d'autres filtres,
fonctionnent déjà en démanganisation biologique.
Dans ce cas précis, le temps de l'ensemencement peut
être réduit de plus de 50%, par rapport aux filtres non
ensemencés (25 jours au lieu de 60 par exemple).
Lavage des filtres:
II est indispensable de laver les filtres :
- à l'air ET à l'eau,
- avec de l'eau traitée non chlorée, ou de l'eau brute (si celle-ci est exempte de fer).
Le filtre sera lavé soit
lorsque la perte de charge atteint la valeur limite
préfixée, soit après une durée maximale
de 2 à 3 semaines si l'évolution de la perte de charge
est très lente : ceci afin d'éviter le
développement de bactéries non spécifiques
indésirables.
Remise en service d'un filtre après lavage : le retour
à une eau filtrée exempte de manganèse est soit
immédiat, soit progressif dans le premier quart d'heure qui
suit la remise en service ; si la station ne comporte qu'un ou deux
filtres, il est donc prudent de prévoir une mise à
l'égout des premières eaux filtrées, pendant
quelques minutes.
Arrêt de longue durée :
Un filtre ayant atteint son rendement de
démanganisation optimal (donc en régime établi)
et maintenu à l'arrêt pendant deux mois, plein d'eau,
retrouve une efficacité supérieure à 95% en 5
jours (eau brute <1 mg/l de manganèse).
Cette observation est intéressante car elle montre que, pour
des installations dont la production serait très variable et
pour lesquelles il faudrait mettre des filtres à
l'arrêt, il est possible, par une gestion judicieuse des
filtres, de retrouver en quelques jours la production et des
performances nominales.
Avantages de la démanganisation biologique.
Les constatations faisant ressortir l'intérêt du
procédé sont sensiblement les mêmes que celles
qui ont été énoncées à propos de
la déferrisation biologique (lien),
en y ajoutant le fait que la démanganisation physico-chimique
requiert impérativement un oxydant fort, lequel est
évidemment supprimé en mode biologique.
Les principaux points forts sont donc les suivants
:
Traitement en
conditions non standards.
Les conditions non standards s'appliquent aux eaux dont certains
éléments présents entraînent une
modification légère du procédé, mais qui
peuvent cependant être traitées par un système
biologique. Ce cas est celui ou la présence de fer et /ou
d'hydrogène sulfuré (H2S)
de teneur importante est soupçonnée.
Chaque cas devrait être étudié
spécifiquement
CAS DES EAUX CONTENANT SIMULTANEMENT DU FER ET DU MANGANESE.
Lorsqu'une eau contient simultanément du fer et du
manganèse, on se heurte à l'obligation d'observer des
conditions de potentiel Redox et de rH différentes pour
l'oxydation de ces deux éléments par voie biologique,
(revoir lien).
En outre, l'élimination du manganèse ne commencera que
lorsque celle du fer sera terminée. Dans de très rares
cas, on peut observer leur élimination simultanée dans
le même filtre, mais au prix d'une vitesse limitée.
Cette solution ne peut être adoptée qu'après une
longue campagne d'essais sur station-pilote ; elle présente en
outre la sécurité d'une filtration sur CAG en aval.
Dans les autres cas, on peut adopter le schéma suivant,
basé sur 2 étages successifs de filtration :
CAS DES EAUX CONTENANT DE L'AMMONIUM.
En déferrisation et/ou démanganisation biologique,
l'ion ammonium ne pourra être éliminé que
:
Rappelons les critères de potabilité relatifs à l'ion ammonium [NH4] et à sa forme transitoire dans le cours de la nitrification, c'est-à-dire l'ion nitrite [NO2] - (revoir lien) - :
|
|
|
|
|
Directives CEE : |
|
|
|
Normes Française |
|
|
La nitrification simultanée sera toujours très limitée au cours des traitements de déferrisation et/ou démanganisation biologique, pour diverses raisons :
En outre, dans les cas de
déferrisation biologique, la faible teneur en O2
dissous constitue un facteur limitant supplémentaire.
De plus, se pose le problème de l'interférence entre
les diverses transformations métaboliques du fer, du
manganèse et des formes réduites de l'azote. Pour le
comprendre, il faut revenir aux diagrammes de
stabilité.
L'examen de la figure suivante permet
de comprendre aisément que si une eau brute contient les 3
éléments à l'état réduit
(Fe2+, Mn2+ et NH4+) et a
un point représentatif qui se trouve de ce fait,
au-dessous de la droite n° 1, la présence
d'ammonium ne gêne pas l'oxydation du fer (P.Mouchet,1994)
:

En revanche, il faut passer la barre
de la droite n° 1 pour atteindre le seuil de la nitrification :
mais la réaction de déferrisation biologique est si
rapide que, sur un plan purement chimique, rien ne devrait s'opposer
à ce que la nitrification démarre dans le même
appareil ; en fait, la nitrification simultanée
à la déferrisation biologique est pratiquement
impossible à cause des vitesses de passage, du faible temps de
séjour, des limitations en O2 dissous).
La nitrification biologique ne peut donc en général
s'effectuer que dans un stade postérieur à la
déferrisation biologique ; en revanche, un retour à la
figure nous montre une situation inverse en ce qui concerne le
manganèse : il faut franchir les lignes 2 et 3 pour atteindre
les lignes 4 ou 5 (suivant le pH), en d'autres termes la
démanganisation biologique n'est pas possible si la
nitrification n'est pas terminée : la présence
d'ion ammonium impose donc. si la concentration en est importante, de
dimensionner le traitement sur la base de la nitrification et non
de la démanganisation biologique.
Ce qui précède peut être résumé par
les figures suivantes, qui illustre l'ordre dans lequel peuvent
s'effectuer les éliminations respectives du fer, de l'ammonium
et du manganèse lorsqu'une eau brute contient
simultanément ces 3 éléments à
l'état dissous, et en fonction des teneurs en NH4.
Le traitement peut être alors basé sur une
filière à 2 étages de filtration biologique,
mais en dimensionnant la deuxième filtration sur les
critères de la nitrification ; la démanganisation
biologique sera alors réalisée en même temps que
la fin de la nitrification.

Cette solution peut convenir jusqu'à une teneur de 0,5 à 2 mg/l NH4, suivant la température de l'eau brute. Avec des concentrations supérieures, on adoptera une solution à 3 étages de filtration biologique :

Durée de mise en service
(ensemencement complet) :
Nous avons vu que la démanganisation seule pouvait demander
1.5 à 3 mois avant l'élimination totale du
Mn2+, ce qui représente le même ordre de
grandeur que la nitrification. Quant les 2 éléments
(NH4 et Mn) sont présents simultanément, il faut donc
prévoir 10 à 15 jours supplémentaires pour
achèvement de la démanganisation après que la
nitrification soit complète, ce qui peut donc
représenter un délai total de 2 à 3.5 mois
après la mise en service électro-mécanique.
CONCLUSIONS GENERALES
La démanganisation biologique répond aux
mêmes critères que la déferrisation biologique,
mais s'applique plutôt aux eaux de pH franchement alcalin.
D'une façon générale, l'application de ce
procédé suppose que l'eau brute est conforme aux normes
de potabilité en ce qui concerne les caractéristiques
autres que le fer, l'ammonium et le manganèse dissous ; les
paramètres de ces traitements sont tels que les chiffres de
turbidité, couleur, matières organiques, etc., seront
peu ou pratiquement pas modifiés au cours de ce
traitement.
L'application d'un procédé biologique restera souvent
d'un coût avantageux.
Chaque fois que c'est possible, on peut envisager les solutions de
traitements biologiques et mesurer soigneusement les avantages qu'ils
peuvent apporter par rapport à la souplesse et à la
sécurité des traitements physico-chimiques. Il faut
envisager ce qui se produira en cas d'inhibition de l'activité
bactérienne et prévoir, chaque fois que cela est
possible, la possibilité d'y suppléer par voie
physico-chimique.
La démanganisation biologique, surtout en présence de
fer, est toujours assez délicate. Il sera prudent, lors de
l'établissement d'un projet, de s'appuyer sur des essais.
Toutefois, il faut se souvenir que ces essais seront
nécessairement assez longs en raison de la durée
d'ensemencement des filtres.
Ainsi il est clairement apparu dans ce chapitre que ces taitements
doivent être conçus "à la carte" ; le
savoir-faire d'un traiteur d'eau expérimenté est
absolument nécessaire pour choisir la meilleure filière
en fonction des caractéristiques de l'eau brute (laquelle
doit, par ailleurs, avoir fait l'objet d'analyses complètes
sur des échantillons représentatifs) et pour fixer les
conditions opératoires dans lesquelles le traitement donnera
les résultats escomptés.
|
|