L'eau oxygénée ou peroxyde d'hydrogène (dioxyde d'hydrogène) fait partie des peroxocomposés, qui sont des composés qui contiennent dans leur molécule des "ponts peroxydes" -O-O-
Formule :
 M
= 34,01 g/mol
M
= 34,01 g/molIntroduction.
L'eau
oxygénée ou
peroxyde
d'hydrogène (dioxyde
d'hydrogène) fait partie des
peroxocomposés, qui sont des composés qui
contiennent dans leur molécule des "ponts peroxydes" -O-O-
Formule :  M
= 34,01 g/mol
M
= 34,01 g/mol
Le pont peroxyde -O-O- serait pratiquement linéaire :
distance O-O d'environ 1,49 Angström (Å)
[nota : 1 Å = 10-10
mètre ou 1 dixième de
milliardième de mètre], et les liaisons O-H
de distance d'environ 0,97 Å.
Toutefois une forme tautomère de type  n'est pas à exclure.
n'est pas à exclure.
Le peroxyde d'hydrogène H-O-O-H ou H2O2 peut être
considéré comme la molécule de base des ces
composés.
C'est un produit industriel important en raison notamment de son
pouvoir oxydant. On l'utilise en pharmacie comme antiseptique, mais
aussi dans beaucoup d'autres secteurs.
(voir Utilisations)
C'est Thénard, en 1818, qui découvrit l'eau
oxygénée par acidification d'une solution de peroxyde
de baryum (BaO2) par l'acide sulfurique
H2SO4 dilué , en présence d'un
peu d'acide chlorhydrique HCl :
HCl se reformant, il joue donc le rôle d'un catalyseur.
Nota : le peroxyde de baryum est lui-même
obtenu par traitement de l’oxyde de baryum BaO, par le
dioxygène O2 .
Actuellement plusieurs procédés sont utilisés
pour préparer l'eau oxygénée, qui sont à
base d'auto-oxydation d'un composé organique : certains
composés agissent (à froid) avec O2 pour
donner un peroxyde qui se décompose pour libérer le
peroxyde d'hydrogène + un produit d'oxydation; par ailleurs ce
dernier pouvant être réduit catalytiquement par
l'hydrogène H2, on peut créer un cycle, avec
régénération du réactif.
Le procédé à la
2-éthylanthraquinone*
(noté Q) est actuellement le plus utilisé (85%
de la production mondiale), connu sous le nom de
procédé Riedl-Pfleiderer, il peut être
schématisé comme suit :
Q est réduite par H2 en hydroquinone (avec
catalyseur au palladium), qui est alors oxydée par
O2 de l'air pour donner un mélange d'
hydroxy-hydroperoxydes, qui par décomposition donne
H2O2 tout en régénérant le
réactif.
Le résultat global en fin de cycle correspond à :
*
C16H12O2 et
formule développée >
 (2-éthyl-9,10-anthracenedione)
(2-éthyl-9,10-anthracenedione)
Propriétés
physiques.
H2O2
pur 100 % (M=34,01 g/mol), n'existe pas dans le commerce
(caractère explosif !) :
On trouve dans le commerce :
- H2O2 à 3% (en poids ou m/m),
- H2O2 à 10 volumes (voir explications à Titre),
- H2O2 à 100 volumes ,
- H2O2 à 30% environ ou 110 volumes (le "Perhydrol" ),
- H2O2 à 35% (m/m),
- H2O2 à 50% (m/m),
- H2O2 à 70% (m/m).
Caractéristiques générales des solutions de
H2O2.

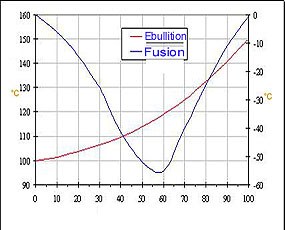
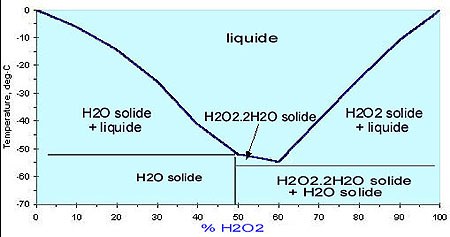


|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Compléments d'informations sur le
produit à 35% :
(utilisé surtout en traitement des eaux pour
potabilisation).
Impuretés :
- Substances extractibles au chloroforme : < 50 mg/kg ou ppm
- Nitrates : < 20 ppm
- Phosphates : < 10 ppm
- Étain : < 10 ppm
- autres métaux : < 0,2 ppm
Informations écologiques :
Effets écotoxiques :
Autres indications concernant l'écologie :
Titre.
Le "titre" ou "volume" (titre volumique) d'une
eau oxygénée correspond au volume, exprimé en
litres, de d'oxygène gazeux
O2 (dioxygène),
mesuré dans les conditions de Température et de
Pression Normales (TPN), dégagé par 1 litre
d'eau oxygénée lors de sa décomposition.
Ainsi par exemple : de l'eau oxygénée "à 100
volumes" signifie qu’un litre de cette eau
oxygénée peut libérer 100 litres de
dioxygène dans les conditions dites "normales".
Nota - Rappel TPN : Température = 0°C, et Pression = 1
atmosphère (atm)
(1,013 bar ou hPa, ou 101 325 Pa).
et sous ces conditions, l'on a la relation :
avec,
[H2O2]
qui est la concentration molaire exprimée en
mol.l-1
Nota : quantité peu précise sujette à diverses
causes d'erreurs.
Remarque :
Une solution molaire de H2O2 , soit
34,01 g/l, peut donc dégazer
½ mole d'oxygène, soit
11,2 litres (TPN),
et le volume libérable est
donc relié au % massique [%
H2O2 en
poids], par la relation :
volume (litre) = ([% H2O2] x (d20 / 100) x 11,2) / 34.01
avec, d20 = densité en kg/m3
Exemple : une solution à 35% ( [%
H2O2]masse
= 35), contient donc 35g de H2O2 pour 100 g de solution,
et compte tenu de la densité (1130 kg/m3 ou
1,13 g/ml) , 39,55 g pour 100 ml ou 395,5 g/litre, ce qui
correspond à (395,5/34.01)= 11,62 moles de H2O2,
soit en volume (11,62 x 11,2) = 130 litres
(environ).
Propriétés
chimiques.
Les monoergols telles que l’eau
oxygénée sont des molécules "instables". On
obtient, par passage sur un catalyseur, une réaction de
décomposition ou dismutation avec émission
d’un gaz pouvant être éjecté.
Et à température
ordinaire,H2O2
est instable et se décompose facilement, avec
libération d'oxygène O2
Équation de dismutation de l'eau
oxygénée :
En fait, les deux demi-équations électroniques d'oxydoréduction sont les suivantes :

(1 =
H2O2
oxydant, 2 =
H2O2
réducteur).
>> potentiels standard des couples oxydoréducteurs :
(mv = millivolts)
- H2O2 / H2O > E° = 1776 mv
- O2 / H2O2 > E° = 680 mv
La dismutation est catalysée, entre
autres, par les sels dissous (en milieu homogène), ce qui
explique la relation entre la stabilité des solutions et la
minéralisation de l'eau.
A noter que les ions phosphates, tartrates
et salicylates peuvent stabiliser les solutions, probablement
par complexation.
Par ailleurs, l'eau oxygénée peut être
considérée comme un acide faible. Le maximum de
stabilité se situe entre des valeurs de pH de 3,5 -
4,5
Remarques :
Les réactions d'oxydations peuvent être violentes, voire
explosives, avec un certain nombre de composés organiques :
acétone, alcools...mais aussi avec le papier, le bois, la
paille ou les textiles, qui sont susceptibles de s'enflammer
spontanément.
à 25°C, K = [(H+)(
HO2-)] / (H2O2) =
2.24 x 10-12
Soit, le pH en fonction du % H2O2 :

Quantités de chaleur :


Utilisations.
On l'utilise dans :
Stockage.
Le peroxyde d'hydrogène et ces solutions aqueuses sont
généralement stockés dans des récipients
en aluminium (qui doit être d'une pureté
égale ou supérieure à 99,5%) ou en acier
inoxydable.
Certaines matières plastiques sont compatibles avec
H2O2 (<50%) :
Nota : des orifices de respiration doivent munir les
récipients.
Le verre teinté peut être utilisé pour de petits
volumes.
Mode de conditionnement :
Dilution : ne devrait être effectuée
qu'avec des eaux douces chimiquement pures (absence de
matières organiques et métalliques).
Lien web US sur H2O2 > http://www.h2o2.com/technical-library/physical-chemical-properties (en anglais).
|
|