GÉNÉRALITÉS
:
Le dioxyde de soufre (anhydride sulfureux ou oxyde
sulfureux) est le résultat de la
combinaison de deux éléments : un atome de soufre
S et 2 atomes d'oxygène O, soit
SO2 .
Masse molaire 64,06 g mol-1.
Le dioxyde de soufre est un gaz dense, incolore et toxique.
Il est utilisé comme désinfectant, antiseptique et
antibactérien ainsi que comme gaz réfrigérant,
agent de blanchiment et comme conservateur de produits alimentaires,
notamment les fruits secs, dans la production de boissons
alcoolisées et plus spécialement dans la fabrication du
vin (il inhibe ou arrête le
développement des levures et bactéries, arrêtant
ainsi la fermentation au moment voulu et assure une
stérilisation du vin).
Des quantités importantes de dioxyde de soufre sont
dégagé lors des éruptions volcaniques (3
à 25 %) et dans certains procédés industriels.
La houille de mauvaise qualité et le pétrole
contiennent des composés de soufre et génèrent
du SO2 lors de leur combustion.
Le dioxyde de soufre et avec le dioxyde d'azote est l'une des
principales causes des pluies
acides, perturbant, voire détruisant des
écosystèmes fragiles. De plus, le
SO2 entraine l'acidification des
océans, ce qui met ainsi l'existence des planctons, animaux
à coquille calcaires et récifs coralliens en
péril. Les planctons produisent la moitié de
l'oxygène terrestre, donc en tuant ces producteurs
d'oxygène, on réduit la quantité
d'oxygène sur Terre.
Propriétés.
Gaz incolore et ininflammable.
Aux conditions normales de pression, c'est un gaz 2,2 fois plus
lourd que l'air (3,049 kg m3-1 à 15°C).
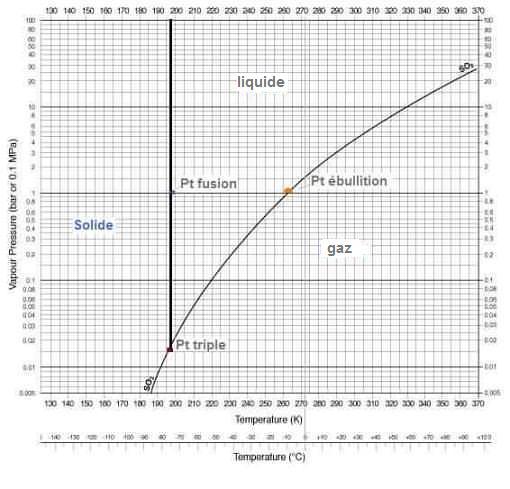
Il se liquéfie à T
• = -10,1 °C
(ou 263,05 K) pour P = 1atm. C'est aussi le
point d'ébullition du gaz
liquide.
Le point de fusion du dioxyde de soufre solide
(glace de
SO2) est de -75
°C (198,15 K), et donc c'est aussi le
point de solidification du SO2 liquide.
Le point triple Pt à T = -76,8 °C
[196,26 K] et P = 14,66 hPa donc
inférieur à la pression
atmosphérique (1 atm=1013,25 hPa), fait
que le SO2 liquide ou solide ne peut
exister à notre pression atmosphérique
"normale".
Le Point critique se situe à P = 7,884 MPa
(78,84 bar) et Tc = 157,6 °C
[430,75 K] .

Il est disponible sous forme de gaz comprimé liquide.
Le SO2 réagit avec l'eau pour former des acides corrosifs. Il
réagit violemment avec les alcalis, et avec la plupart des
métaux en présence d'humidité, en
libérant de l'hydrogène
(lien),
gaz extrêmement inflammable. En présence d'eau il
entraîne une corrosion rapide de certains métaux.
Normalisation.
Norme sur les produits utilisés pour la production
d’eau potable : bulletin
officiel - Dioxyde de soufre (Anhydride sulfureux) : NF EN
1019.
Utilisations.
Effet sur la santé.
Divers.
Téléchargement des Fiches Techniques de
Sécurité [Air Liquide] (
fichier .pdf, ici ).