|
|
|
|
L'


 - Définition (tentative) <
- Définition (tentative) <

La définition d'une eau potable est très
malaisée...
C'est en effet un terme générique qui ne peut s'appuyer
sur un type unique, car toute eau que l'on peut consommer sans danger
peut être considérée comme potable.
A cette notion de danger potentiel peut se superposer une notion
d'agrément vis-à-vis du goût et même de
confort (aspect, température).
On pourrait dire, qu'une eau destinée à la
consommation humaine
doit
:
Ue professeur (Le Strat) utilisait cette formule simple :
A la réflexion, il s'agit là de beaucoup plus qu'une
simple "boutade"...
Les qualités organoleptiques (terme qualifiant les
substances qui peuvent impressionner les organes sensoriels)
attendues d'une eau de boisson sont la limpidité,
l'absence de couleur et d'odeur, l'absence de saveur
désagréable et enfin la fraîcheur.
L'eau doit d'autre part, présenter des caractéristiques
satisfaisantes des points de vue physique, chimique et
bactériologique.
Les autorités sanitaires, et en particulier le Conseil
supérieur d'hygiène publique de France
( CSHPF
), ont précisé, au travers d'une
législation, les valeurs limites des paramètres les
plus importants, paramètres à ne pas dépasser
pour pouvoir qualifier une eau de potable.
On pourrait donc dire qu'il n'existe pas d'eau potable, mais
seulement d'eau conforme aux normes...
Rappel - Qualité de l’eau potable (2006) :
310 000 prélévements réalisés dans le cadre du contrôle sanitaire,
(Ministère chargé de la santé
- Données 2006 - L’eau potable en France
2005-2006).
Gestes pour
profiter d'une eau de meilleure
qualité ?

Une eau est caractérisée par un ensemble de
paramètres accessibles à l'analyse.
Tous ces éléments constituent la
minéralisation de l'eau dont l'importance dépend
évidemment de la nature géologique des terrains
traversés.
En suivant la classification de la législation
française, on distingue :
Un excès de certains sels peut rendre l'eau désagréable à boire (Chlorure de sodium ou de magnésium) ou même provoquer des désordres physiologiques (Sulfate de Magnésium laxatif, propriété de certaines eaux minérales). C'est pourquoi la réglementation fixe des limites de concentration pour ces ions.
On classe dans cette rubrique : nitrates, nitrites, ammonium,
azote Kjeldahl, oxydabilité, COT (carbone organique total),
hydrogène sulfuré, hydrocarbures dissous,
phénols, Bore, détergents, organo-chlorés
autre que les pesticides, phosphore, chlore libre résiduel,
matières en suspension, baryum et argent.
La découverte de germes banals dont l'origine fécale est établie indique donc un risque de présence de germes pathogènes sans qu'il soit besoin de la vérifier.
Il faut bien avoir à l'esprit que, même en cas de pollution importante, aucune eau ne peut entraîner un risque de toxicité aiguë. Il ne peut exister qu'un risque de toxicité chronique par effet d'accumulation, comme cela a été observé pour le plomb (saturnisme) ou le mercure (maladie de minamata).
Une eau naturelle ne constitue pas un milieu favorable au développement des bactéries (température trop basse, quantité de nutriments insuffisante). Lors du prélèvement d'un échantillon, on peut observer une phase de multiplication pendant quelques heures, puis une phase de décroissance. La multiplication des germes dans un réseau de distribution ne peut donc se produire que si ce dernier présente des zones de dépôts riches en matières organiques favorables à la fixation des bactéries et leur apportant la nourriture nécessaire. A partir de ces niches, les bactéries pourront croître et constituer un revêtement mucilagineux très mince dans les conduites, appelé biofilm. Ce dernier est constitué par les excréments et les cadavres de micro-organismes (endotoxines), et constitue une nouvelle source d'énergie pour les bactéries.
Le maintien d'une condition aseptique en réseau passe donc, en l'état de la technique, par l'obligation de conserver à l'eau un pouvoir bactériostatique pendant toute la durée de son séjour.
Ceci est obtenu par l'injection d'un désinfectant rémanent (chlore ou composé de chlore) avant introduction de l'eau dans le réseau.
Si le temps de séjour en réseau est élevé, il sera nécessaire de procéder à une chloration complémentaire "en route" (généralement aux réservoirs) pour maintenir un résiduel bactériostatique de désinfectant jusqu'au robinet de l'abonné, sans avoir à introduire une quantité inacceptable de chlore au départ.
Dans certaines circonstances (long séjour, zones de faible
circulation, température élevée, présence
d'ammoniaque, eau riche en matières organiques), cette
obligation de maintient d'un résiduel de chlore peut
entraîner le développement de goûts
désagréables et/ou la formation de composés
organo-chlorés soupçonnés d'être
cancérigènes).
L'évolution des techniques pour éviter cette obligation
vise donc à réduire aussi complètement que
possible les teneurs en matières organiques (et
spécifiquement en Carbone Organique Dégradable
Biologiquement - CODB) - de l'eau traitée.
Outre les techniques désormais classiques de couplage oxydant fort / charbon actif, la filtration sur membranes (nanofiltration), répond en grande partie à ce problème.
Des micro-organismes plus évolués que les bactéries peuvent être également rencontrés dans l'eau (helminthes, protozoaires tels que amibes, cryptosporidium, etc.) et peuvent présenter des risques pour la santé. La réglementation française n'en n'impose pas la recherche actuellement. Cependant, le sujet est activement débattu Ce risque pourrait entraîner la mise en place de nouvelles obligations pour le traitement des eaux (granulométrie des matériaux filtrants, rinçage des filtres après lavage avec décharge des premières eaux, traitement spécifique des eaux de surverse d'épaississeur, etc.).
ANALYSE
D'UNE EAU
Pour que les résultats d'analyse provenant de
différents laboratoires puissent être comparés,
il est évidemment nécessaire que ces laboratoires
utilisent les mêmes méthodes et le même mode
opératoire.
Les méthodes officielles sont mises au point par un petit
nombre de laboratoires dont la compétence est unanimement
reconnue (laboratoires de référence). Elles font
ensuite l'objet d'une normalisation à l'échelon
français (AFNOR) ou européen (ISO).
Ces méthodes sont rendues obligatoires par un arrêté ministériel spécifique qui est périodiquement mis à jour (le dernier est l'arrêté du 24.07.89).
Il serait beaucoup trop long d'exposer ici ces méthodes. Je renvoie ceux que cela intéresse vers les documents suivants :
INTERPRETATION DE L'ANALYSE.
Même pour un non-spécialiste, il peut être
intéressant de savoir interpréter une analyse d'eau, de
vérifier sa cohérence, de savoir détecter
d'éventuelles erreurs, voire de reconstituer la teneur en
certains ions manquants.
Il est nécessaire pour cela d'être familier avec les
systèmes d'unités utilisés, ainsi qu'avec
certains paramètres spécifiques à la chimie dans
les eaux.
Rappel de quelques
Termes
ou expressions utilisés en chimie :
lien interne
.
Rappel des termes utilisés
principalement en chimie de l'eau.
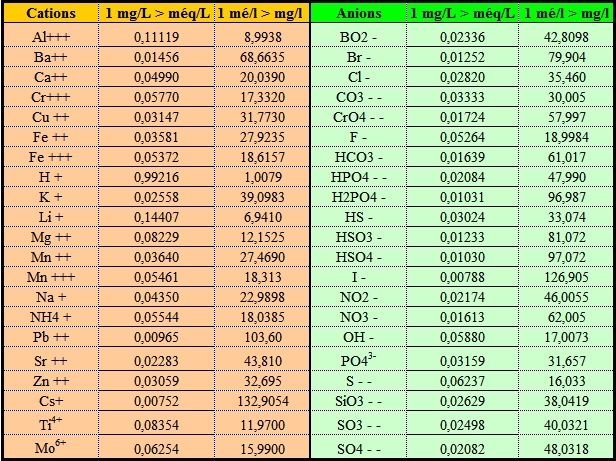
Notion de milliéquivalent et de degré.
Dans les analyses, la concentration des différents
éléments est presque toujours exprimée en mg/L
ou en microgramme/L (mg/L), pour les
éléments traces (1 mg/L= 103 mg/L).
On trouve aussi parfois, spécialement dans les documents
provenant des U.S.A., une expression de la concentration en ppm
(partie par million). En toute rigueur, le ppm se rapporte à
une concentration poids pour poids. Mais on ne fait pas une
grande erreur en l'assimilant au mg/l ou encore au g/m3 lorsqu'il
s'agit de solutions extrêmement diluées comme l'eau
naturelle. L'expression en mg/l n'est pas commode pour
contrôler les résultats d'une analyse. Il faut dans ce
cas la remplacer par le milliéquivalent (g) par litre qui se
note mé/L ou encore meq/l.
NOTA : l'équivalent gramme (ou poids
équivalent) est défini par le quotient de la masse
atomique du corps simple considéré, par sa valence
(nombre d'électropolarité).
Par exemple, la masse atomique du calcium Ca2+ étant de 40,078
g et ce corps étant bivalent, l'équivalent-g vaut donc
40,078/2= 20,039 g, et un milliéquivalent = 20,039 mg
(une solution à 5 g/L de calcium renfermera 5
/20,039 = 0,2495 équivalent/L, soit 249,5
mé/).
Si l'élément considéré est monovalent,
par exemple le chlore Cl- qui a une masse de 35,46, 1
mé/L vaudra donc (35,46/1) = 35,46 mg/l.
(voir tableau plus loin)
Cette notation présente plusieurs avantages :
Dans la chimie de l'eau, on a souvent besoin de connaître
non pas le détail des différents ions présents,
mais plutôt la somme de certains d'entre eux (Ca+2 ,
Mg+2, carbonates, bicarbonates, etc.). Il s'agit des
titres dont nous reparlerons plus loin. Dans ce cas, une mesure
exprimée en mg/l n'aurait évidemment aucune
signification, alors que mé/l permet une évaluation
immédiate.
Cependant, une très vieille habitude a été
conservée par les traiteurs d'eau français qui consiste
à évaluer ces titres dans une unité un peu
"désuette", le degré français (°f ou
°F).
NB : ne pas confondre avec le symbole °F, degré
Fahrenheit !
Il faut donc savoir que 1 équivalent / litre = 5000
°f/L, donc 1 milliéquivalent par litre (mé/l)
= 5 °f/L ou 1°f/L = 0,2 mé/L.
Le degré français est donc une unité de
concentration qui peut être utilisée comme le
mé/L pour exprimer la dose de tout sel soluble contenu dans
une eau.
Très généralement utilisée il y a
quelques dizaines d'années, cette notation ne s'applique plus
guère qu'aux "titres" tels que TA, TAC, TH, etc.
Son usage est cependant encore très répandu dans le
domaine du traitement d'eau par échange d'ions.
Nota :
|
|
|
|
|
de CaCO3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ou °Clark |
|
|
|
|
|
|
|
|
|
|
|
|
|
de CaCO3 |
|
|
|
|
|
Unités spécifiques
Il a été vu les unités se rapportant
à la mesure de la couleur (mg/l Pt Co ou degré Hazen)
de la turbidité (NTU, FTU, JTU, gouttes de mastic, etc.).
En ce qui concerne l'évaluation de la saveur et de l'odeur, le
principe de la méthode est d'établir des dilutions avec
de l'eau sans odeur, ni goût (?),
jusqu'à disparition de la perception olfactive ou gustative.
Ceci détermine un "seuil".
Par définition, le seuil 1 est celui d'une eau sous analyse,
sans goût ni odeur.
Une eau présentant un seuil d'odeur ou de goût de 10
résulterait de la dilution de 1 volume d'eau sous analyse avec
9 volumes d'eau de référence.
Nous avons vu également que la minéralisation globale
d'une eau pouvait être approchée par une mesure de
conductivité électrique ou de
résistivité. qui est son inverse.
L'unité de résistivité R est
l'ohm.cm/cm2.
L'unité de conductivité est le Siemens par
mètre (S/m).
Cette unité étant très grande on utilise le
sous-multiple, le micro-siemens : 1 S = 106mS.
La correspondance entre ces deux unités est donc : R =
106 / mS
Dans certains bulletins, on trouve la conductivité
exprimée en mho .1 mho = 1 / ohm .
Contrôle des résultats
d'analyse
Il n'existe aucune méthode vraiment satisfaisante
et absolue pour contrôler les résultats d'une
analyse.
Il est cependant indispensable d'identifier des erreurs importantes
ou l'omission d'un ion en quantité significative,
c'est-à-dire supérieure à environ 5 % d'anion ou
de cation. Un résultat satisfaisant ne devrait pas mettre en
oeuvre une différence supérieure ou inférieure
à 2 %.
En pratique, on ne considère pour les contrôles que les ions dits "majeurs", soit :
Les autres éléments qui ne sont présents dans
les eaux qu'à des quantités infimes échappent
à ce contrôle.
On utilise très généralement la méthode
de la balance ionique et , dans une moindre mesure, celle utilisant
la conductivité.
Méthode de la conductivité
F. DIENERT a établi une formule valable pour des eaux dont
la conductivité est de l'ordre de 400 à 500
mS/cm. Dans ce cas, la conductivité
(exprimée en mS/cm à 18
°C) peut être reliée à la concentration des
ions par les relations :
Si la minéralisation de l'eau excède les valeurs de conductivité citées ci-dessus, on dilue l'eau à analyser avec de l'eau distillée pour ramener la valeur de conductivité dans la gamme 400/500 mS/cm.
Signification des titres
Comme évoqué plus haut, on rencontre dans les
analyses des évaluations globales fort précieuses pour
des calculs rapides. Il s'agit de ce qu'il est convenu d'appeler les
titres. On distingue :
Par convention, ces titres, qui ne se rapportent pas à un
ion spécifique, sont toujours exprimés en
degrés français, comme par exemple la
dureté.
Echelle de dureté :

Dans les eaux naturelles, le TA ne peut apparaître que si leur
pH est supérieur à 8,3. La répartition des ions
constitutifs de l'alcalinité peut être calculée
à partir des valeurs respectives de TA et TAC.

On peut tirer un certain nombre d'enseignements de la mesure des
titres :
TH et TAC représentent la concentration en sels de
Ca+2 ou Mg+2 autres que les bicarbonates,
soient les chlorures, sulfates, nitrates. Il s'agit du TH dit
permanent.
Dans quelques cas assez rares, TAC est supérieur à TH.
Ceci veut dire que l'eau renferme des bicarbonates alcalins
(Na+ ou K+).
Si TH = TAC, il ne peut y avoir d'autres sels de Ca+2 ou
Mg+2 autres que les bicarbonates.
Dans ce cas, le TAC représente le TH dit
temporaire.
Il serait beaucoup trop long et fastidieux de passer en revue les
63 paramètres caractéristiques retenus par la
législation.
Je recommande la lecture du chapitre consacré à ce
sujet dans l'ouvrage de J. RODIER déjà cité.
Eaux : contrôle sanitaire :
> Demande
d'agrément des laboratoires pour les
prélèvements et analyses / février 2005
(Actualisation avril 2005)
> L'Eau
Potable en France - Bilan 2005-2006 (Ministère de la
Santé, 2007).
Attitude des consommateurs sur l'eau au quotidien.
> édition du baromètre C.I.EAU/TNS-SOFRES 2008
(13e édition, publiée en 2009,
lien),
>> Téléchargez
le baromètre (pdf, 970 ko).