
Généralités.
Étant donné la diversité des micro-organismes
présents dans l'eau à traiter, les conditions de
désinfection adoptées doivent permettre un traitement
efficace sur toutes les populations de germes. Ceci doit
également être valable si l'eau à
désinfecter est momentanément turbide, ou
possède une certaine teneur en matières organiques, qui
pourraient interférer lors de la désinfection. Dans la
pratique, pour prendre en compte ces considérations, on
recommande des conditions de CT pour chaque désinfectant.
Dans ce cas, T correspond au temps de contact moyen dans la
bâche de désinfection, et C au résiduel d'oxydant
mesuré en sortie de la bâche.
Chlore.
Conditions bactéricides : maintien d'un
résiduel de chlore libre de 0,1 à 0.2 mg/l pendant 10
à 15 minutes (à pH < 8).
Conditions virulicides : 0,3 à 0,5 mg/l pendant 30
à 45 minutes (à pH < 8).
Bioxyde de chlore.
Conditions bactéricides : 0,1 à 0,2 mg/l pendant
5 à 10 minutes.
Conditions virulicides : 0,3 à 0,5 mg/l pendant 30
minutes.
Ozone.
Conditions bactéricides : 0,1 à 0,2 mg/l pendant
1 à 2 minutes.
Conditions virulicides : 0,3 à 0,5 mg/l pendant 4
minutes.
Désinfection U. V. - Notion de dose d'exposition
létale :
La quantité d'énergie reçue par un
micro-organisme soumis à un rayonnement U.V. est égale
à
avec :
- D : énergie reçue par unité de surface ou dose d'exposition (mJ/cm²).
- I : puissance reçue par unité de surface, dépendant de la puissance de lampe utilisée, de sa géométrie, du trajet parcouru par le rayonnement U.V., et du coefficient d'absorption des U.V. dans l'eau à traiter (µW/cm²).
- t : durée d'exposition au rayonnement (secondes).
La dose d'inactivation (dose d'exposition létale),
dépend du micro-organisme cible. La résistance des
germes au rayonnement U.V. peut varier de manière
importante.
D'une manière générale, on considère que
la dose de rayonnement appliquée doit être d'au moins 25
mJ/cm² (ou 250 J/m²). Les effets bactéricides et
virulicides sont immédiats, mais il n'y a pas de
rémanence.
CHLORE GAZEUX.
Action du chlore.
Le chlore gazeux (Cl2) est dissous dans l'eau à
une concentration comprise entre 1 et 2 g/l et il réagit
suivant la réaction :
(formation d'acide hypochloreux HClO et d'acide chlorhydrique
HCl),
qui s'accompagne de la réaction secondaire :
(formation de l'ion hypochloreux ClO- et de l'ion
hydrogène H+,
ceci donc, en fonction du pH (et de la température) :

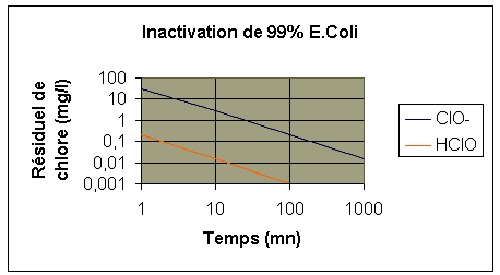
C'est l'acide hypochloreux (formule : HClO -
masse molaire : 52,5) qui est le véritable agent
désinfectant. Il est désigné par le terme
«chlore libre actif» par opposition au chlore libre en
réserve sous forme d'hypochlorite ClO- et au chlore
combiné composé de monochloramine, dichloramine et
trichloramine, résultant de la réaction du chlore sur
l'ammoniaque et les matières organiques qui donnent des
chloramines organiques.
Pour une teneur en chlore libre donnée, le pourcentage de
formation de chlore libre actif est d'autant plus élevé
que le pH et la température sont plus bas.
Formes chlorées en fonction du pH :

Nota :
Un des mécanismes biocides des réactifs chlorés
a été mis en évidence
(Université du Michigan - USA, 2008)
:
HClO aurait pour effet de déstructurer les chaînes des
protéines bactériennes, qui, de ce fait perdraient leur
fonction. Par ailleurs, des sites actifs jusqu'alors
protégés deviennent "visibles" et actifs, ce qui se
traduit par des agrégations de protéines (en "grosses"
pelotes) et forment donc des déchets qui amènent
finalement la morts des bactéries.
Demande en chlore libre - Point-de-rupture.
Eau sans ammoniaque :
Lorsque l'on ajoute du chlore en quantités croissantes
à l'eau et que l'on mesure après un temps de contact
donné (en général 30 mn) le chlore
résiduel total et le chlore libre, on constate que la teneur
en chlore est nulle jusque un certain taux de chlore injecté,
à partir duquel il est décelé du chlore
résiduel total. Cette consommation de chlore représente
la demande en chlore de l'eau.
Ensuite, la teneur en chlore résiduel total augmente
proportionnellement avec le taux de chloration.
Eau contenant de l'ammoniaque :
On retrouve le phénomène de la demande en chlore,
puis en augmentant le taux de chloration,
la teneur en chlore résiduel total :
- commence par croître,
- puis décroît jusqu'à un minimum,
- et de nouveau, se remet à croître.
Le chlore libre est nul tant que le chlore résiduel total
n'a pas atteint ce minimum, et ce n'est qu'au delà qu'il
commence à croître.
Le chlore combiné commence par croître puis
décroît ensuite constamment.
On appelle "point de rupture" (ou BP, break-point) le taux de chlore
nécessaire pour obtenir le minimum de chlore résiduel
total.

avec,
A : destruction du chlore par les composés
minéraux,
B : formation de composés chlorés organiques et de
chloramines,
C : destruction des chloramines par ajout de chlore
supplémentaire,
D : production de chlore actif.
La chloration au break-point entraîne la disparition totale de
l'ammoniaque.
Pratiquement, pour être sûr de chlorer au delà du
BP, il faudra avoir dans l'eau un chlore résiduel libre d'au
moins 0,4 mg/l, et une différence entre chlore résiduel
total et chlore libre aussi faible que possible.
Des essais montrent que le taux de chloration est égal
à environ 10 fois le taux d'ammoniaque à
éliminer.
Certain procédé (REGAM - Brevet CGE par exemple)
permettent d'ajuster automatiquement le taux de chlore injecté
à partir de la mesure du chlore libre lorsque la teneur en
ammoniaque de l'eau est variable.
Points d'application du chlore.
Une chloration bactériostatique est réalisée
impérativement en fin de filière de traitement
(même après une postozonation) à un taux assurant
un résiduel de chlore libre de 0,4 mg/l au minimum.
Le point d'injection sera aussi éloigné que possible de
la sortie de la tour de postozonation, du fait de la
compétition de ces 2 agents désinfectants.
Suivant la configuration du réseau, il se peut qu'en des
points éloignés de l'usine de production, il ne soit
possible d'avoir un résiduel suffisant qu'au prix d'un
résiduel très important en sortie d'usine. Dans ce cas
des chlorations en divers points du réseau peuvent être
envisagées.
Pour l'élimination de l'ammoniaque il sera recherché un
point de chloration intermédiaire où l'eau est
débarrassée au maximum des matières organiques
et à l'aval duquel il est possible de disposer d'un temps de
contact d'une heure environ avant la sortie d'usine, temps
nécessaire pour la disparition des chloramines responsables de
mauvais goût La formation de Trihalométhanes sera
également réduite.
Dans bien des cas, la seule possibilité réside dans la
chloration de l'eau décantée (au détriment de
l'élimination biologique au cours de la filtration).
Stockage distribution du chlore.
Le chlore est stocké dans des bouteilles de 50 kg ou des
tanks de 1 000 kg sous une pression de 5 bars environ : il est donc
à l'état liquide.
C'est un gaz jaune verdâtre, irritant, deux fois et demi plus
lourd que l'air (d = 2.491) et qui peut occasionner des
dégâts importants en cas de fuite.
La constitution d'un dépôt d'une capacité
supérieure actuellement à 150 kg est soumise à
une réglementation qui impose notamment l'installation dans un
local séparé, d'un dispositif de neutralisation des
fuites :
L'installation est enclenchée automatiquement à
partir d'un détecteur de fuite.
Des dispositions de sécurité sont
à prendre par le personnel lors de leur intervention sur les
récipients de stockage.
La distribution est assurée à l'aide de
chloromètres montés directement sur les
récipients et à fonctionnement sous vide, ce qui permet
d'assurer une fermeture automatique du récipient en cas de
fuite sur la conduite véhiculant le chlore gazeux.
Le chlore étant stocké à l'état liquide
et soutiré à l'état gazeux, pour une
température de 20° C environ, les débits maxima
pouvant être soutirés sont de :
- 1 kg/h pour une bouteille de 50 kg,
- 20 kg/h pour un tank de 1 000 kg.
Nota : 1 litre de chlore liquide = 456,81 litre de Cl2 gazeux
(0°C et pression de 1 atm).
Toxicité :
- 50 mg/l pendant 1 h > issue fatale possible,
- 500 mg/l pendant 5 mn > issue fatale,
- 1000 mg/l instantanément > issue fatale.
-----------------------------------------------------------------------------------------------------------------
Lien
(canadien) sur les effets du gaz chlore sur la
santé.
Eau
de Javel.
(hypochlorite de sodium diluée).
Lorsque l'on injecte de l'hypochlorite de soude dans l'eau, aux
valeurs de pH habituellement rencontrées, une partie de l'ion
ClO- se transforme en acide hypochloreux HClO et donc
l'hypochlorite de sodium a les mêmes pouvoirs que le chlore
gazeux.
La solution commerciale classique est à une concentration de
47-50° chronométrique français (Cl),
Nota : le degré chronométrique français
exprime, en litre de chlore gazeux sec (à T = 20°C
et P = 1 bar), le pouvoir oxydant de 1 litre de solution
d'hypochlorite de soude,
(mêmes T et P).
Or à 20°C, et P = 1 bar, 1 litre de chlore gazeux
pèse 3,17 g, donc 1°Cl =3,17 g de chlore, soit
donc, environ 149 à 158 g de chlore par litre de solution
commerciale (la densité est de 1,20 à 1,22).
Elle peut être livrée par touries, containers, ou par
camions-citernes. Elle est alors stockée dans des cuves en
plastique à l'intérieur d'un cuvelage étanche de
rétention et à l'abri de la lumière pour
éviter sa décomposition.
A noter que l'hypochlorite de soude se conserve d'autant mieux que la
température est plus basse.
Par suite du dégazage du chlore, pour éviter les
désamorçages des pompes doseuses de distribution, des
évents sont à prévoir sur les conduites
d'aspiration et de refoulement.
Appellation anglaise : Chlorine bleach, Bleach, Sodium
hypochlorite.
Toxicité :
NOTA : voir également les pages spéciales sur l'eau de Javel.
Dioxyde
de chlore.
De formule ClO2, c'est un produit instable qui doit
être préparé sur le lieu d'utilisation par :
Dans ce second procédé pour obtenir la même
quantité de dioxyde de chlore, il faut 2,5 fois plus de
chlorite de soude. Il est donc plus coûteux et
réservé aux usines où il n'est pas possible de
disposer d'un dépôt de chlore gazeux.
Pour la fabrication du dioxyde de chlore à partir de chlore
gazeux, dans les réacteurs modernes à boucle
d'enrichissement d'eau chlorée, il faut :
- 0,6g de chlore
- 1,34 g de chlorite de soude
pour obtenir 1 g de dioxyde de chlore.
La solution de ClO2 doit être peu concentrée
et distribuée immédiatement.
Le chlorite de soude peut être livré :
— soit en poudre pour la préparation d'une solution à une concentration maximale de 200 g/1. Il est alors nécessaire d'utiliser de l'eau adoucie pour éviter la précipitation de carbonates,— soit en solution concentrée à 300 g/l et de densité 1,23.
C'est un produit dangereux à
manipuler et les solutions concentrées sont à
conserver à une température supérieure à
10°C.
Les réactifs et le réacteur (générateur)
doivent être installés dans des locaux
indépendants ouvrant directement sur l'extérieur.
Exemple d'installation :

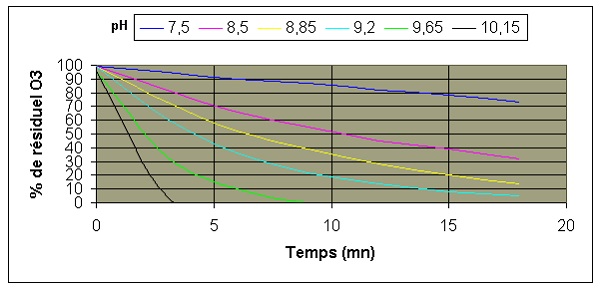
Les avantages du dioxyde de chlore peuvent se résumer ainsi :
Mais il présente un certain nombre d'inconvénients :
Mode d'action.
Grâce à son potentiel élevé
d'oxydation, l'ozone oxyde les composants de cellules de la paroi des
cellules bactériennes.
C'est une conséquence de la pénétration des
parois de cellules. Une fois que l'ozone entre dans les cellules, il
oxyde tous les composants essentiels (enzymes, protéines, ADN,
ARN). Quand la membrane cellulaire est endommagée durant ce
procédé, la cellule se brise. Ceci est appelé la
lyse.
Le mécanisme mentionné ci-dessus diffère des
ceux des halogènes (tels que le chlore), qui sont
généralement employés. Le chlore est connu pour
pénétrer les cellules par diffusion. A
l'intérieur de la cellule, le chlore affecte plusieurs types
d'enzyme.
Suivant les conditions d'utilisation et les milieux
réactionnels, l'ozone peut agir dans l'eau selon quatre
procédés d'oxydation :
Ainsi l'ozone possède de nombreuses propriétés qui sont mises à profit pour :
- la destruction de presque tous les goûts et odeurs,
- la décoloration de l'eau,
- la destruction en forte proportion des algues,
- la destruction des germes pathogènes, 20 à 30 fois plus rapide qu'avec le chlore,
- l'inactivation des virus,
- l'élimination de certains pesticides,
- la destruction des détergents en très fortes proportions,
- l'élimination complète des phénols,
- la réduction très sensible des substances extractibles au chloroforme (qui constituent une mesure analytique globale des micropolluants organiques),
L'ozone est sans effet sur l'ammoniaque.
La matière organique se trouve donc partiellement
oxydée et devient plus facilement biodégradable. Ceci
entraîne une plus grande quantité de carbone organique
dissous biodégradable (CODB, ou BDOC en anglais). Par
conséquent, l'ozone améliore le procédé
d'élimination de la matière organique naturelle par un
filtre subséquent, lorsqu'il est utilisé en tant que
pré-oxydant.
En combinaison avec un filtre biologique, ce traitement a,
généralement, pour conséquence la
réduction de 40 à 60% du carbone organique dissous
(COD).
Notons que la combinaison coagulation–ozone–bio filtration,
permet une réduction du COD d'environ 65%. Lorsque la
bio-filtration seule était utilisée, le taux de
réduction est seulement de 10-15%.
Nota : une dose d'ozone de 0,4 mg/L pendant 4 minutes est
généralement efficace pour de l'eau
prétraitée.
Par ailleurs, l'ozone peut être efficace pour l'oxydation de
plusieurs pesticides. Dans une unité de traitement de l'eau au
Pays-Bas, il a été prouvé que trois
barrières (stockage>ozonation>filtre à charbon
actif (filtre CAG)) sont efficaces et assez sures pour
l'élimination des pesticides. Sur 23 pesticides testés,
50 % furent suffisamment dégradés (80 %
de dégradation).
Pour les pesticides très résistant, un plus fort dosage
d'ozone est conseillé, ou de l'ozone combiné au
peroxyde d'hydrogène.
La combinaison "combinaison coagulation–ozone–bio
filtration" a donc plusieurs avantages :
Comme c'est le cas pour l'oxydation des pesticides, l'ozone
combiné au peroxyde d'hydrogène est plus efficace que
l'ozone seul. La geosmine et le 2-méthylisoborneol (MIB) sont
des exemples de composés odorants résistants, qui sont
souvent présents dans l'eau. Ils sont produits par une algue
et ont une faible odeur et un léger goût.
Néanmoins, l'ozone a encore une très grande action sur
ces composés.
Exemple d'effet de l'ozone et de traitement subséquent pour la
réduction de le goût et l'odeur effectués sur un
pilote de traitement à Saint-Maur (France) :
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
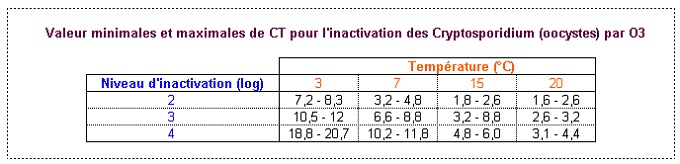
(d'après Études et Publication
Perrine D, Langlais B, Georges P - 1990)
Autres applications.
Nota : ces autres applications ne constituent pas le stade de
désinfection par l'ozone appelé
« post-ozonation ».
L'ozone peut donc être injecté :
Principe
d'une installation d'ozone.
Une installation d'ozone comprend 4 parties :
- Traitement de l'air;
- Génération de l'ozone.;
- Mise en contact de l'eau et de l'air ozonée ;
- Devenir de l'ozone des évents.
Exemple de schéma général d'une installation d'ozone :
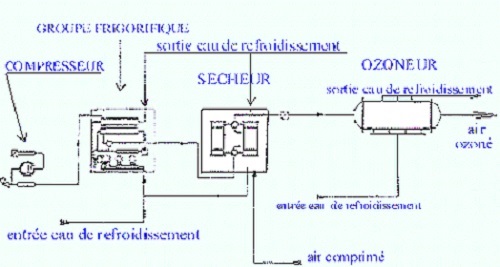
1 - Traitement de l'air.
D'une manière générale le conditionnement de
l'air est assuré par les équipements suivants :
L'air traité doit être parfaitement dépoussiéré, froid et extrêmement sec
ceci pour la sauvegarde des matériaux entrant dans la
fabrication des ozoneurs et pour le rendement de production.
Au cours de la formation ce l'ozone, l'ionisation de l'air forme des
composés oxydés de l'azote, principalement
N2O et N2O5. En présence
d'eau, l'anhydride nitrique se transforme en acide très
corrosif.
Les compresseurs ou surpresseurs sont des machines
bruyantes dont le réchauffement est important. Ils sont
installés dans un local insonorisé et très
aéré, soit naturellement, soit par ventilation
forcée.
Exemple de schéma de principe d'installation du traitement de
l'air:
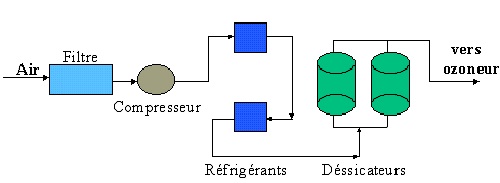
2 - Génération de
l'ozone.
L'ozone étant instable il doit être produit sur les
sites d'utilisation.
Une production d'ozone est en réalité l'enrichissement
d'un courant d'oxygène (oxygène pur ou air), en ozone,
obtenu en soumettant celui-ci à un arc électrique.
Un ozoneur industriel est un
assemblage de tubes (générateurs)
élémentaires constitués de deux
électrodes conductrices situées en regard l'une de
l'autre :
- une électrode centrale en acier inoxydable,
- une électrode de masse constituée par un tube en acier inox refroidi par circulation d'eau.
L'espace entre elles est occupé par deux
diélectriques dont l'un est en verre très mince
à permitivité élevée et l'autre l'air ou
tout autre mélange gazeux oxygéné.
Sous l'action d'une tension alternative de faible valeur, le
système se comporte comme un condensateur.
Exemple de schéma d'un tube élémentaire :
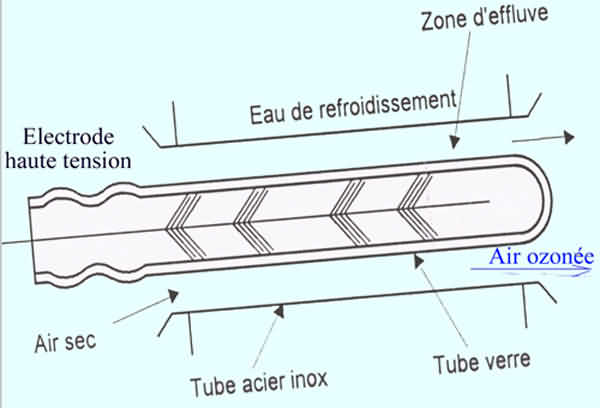
Pour des tensions supérieures à une limite dite seuil,
le gaz s'ionise et devient conducteur de l'électricité,
on observe l'apparition de décharges lumineuses et la
formation d'ozone.
La production d'ozone peut être ajustée par
réglage de la tension appliquée de façon
manuelle ou automatique à partir d'un analyseur d'ozone
résiduel, par exemple pour une postozonation.
La majeure partie de l'énergie est dispersée sous forme
de chaleur qui est évacuée par l'eau circulant autour
de l'électrode de masse.
L'eau de refroidissement est en général de l'eau
prélevée sur le circuit d'eau de service de l'usine et
restituée à la citerne d'eau traitée. Si la
teneur de cette eau est quelque peu élevée en
chlorures, pour éviter l'attaque de l'acier inox, il est
nécessaire de prévoir un circuit fermé d'eau de
refroidissement.
Exemple de batterie d'ozoneurs industriels
(1995-2000) :

 -
- 
3 - Mise en contact de l'eau et
de l'air ozonée.
Trois modes de diffusion peuvent être utilisés :
La diffusion est réalisée dans des cuves en béton armé :
Exemple de tour de diffusion d'ozone :
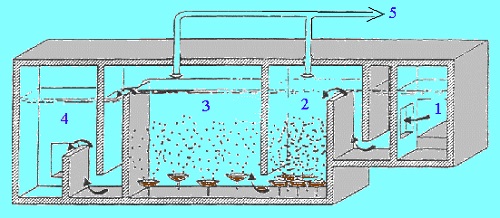
Avec :
|
1 - Siphon d'entrée |
|
2 - 1er compartiment |
|
3 - 2ème compartiment |
|
4 - Siphon de sortie |
|
5 - O3 vers le destructeur thermique |
Dans le premier compartiment le contact a lieu à
contre-courant et dans le second à co-courant. Pour obtenir un
rendement satisfaisant, la hauteur d'eau au-dessus des poreux doit
être comprise entre 3,50 et 4 m. La tour comporte des
«joints hydrauliques» pour que l'air ozone reste
emprisonné à la partie supérieure afin
d'être évacué par des évents.
4 - Devenir de l'ozone des évents.
L'ozone qui se dégage inévitablement à la
partie supérieure de la tour de post-ozonation peut être
:
• passage sur un lit catalytique (catalyseur à base de palladium ou de manganèse).
Destruction des
réactifs.
Destruction de l'OZONE OU CHLORE
résiduels :
II peut être nécessaire quelquefois de
détruire l'ozone résiduel de l'eau
(pompage auxiliaire en sortie de tour de
postozonation) ou le chlore résiduel
(lavage des filtres à l'aide d'eau non
chlorée) par injection de Sulfite de sodium, Disulfite
de sodium, Sulfate ferreux ou Dioxyde de soufre (SO2).
Le plus souvent :
du bisulfite de soude ou disulfite de sodium
(Sodium Hydrogénosulfite -
NaHSO3).
Celui-ci est livré en solution commerciale à
310g/l de gaz sulfureux SO2 (500 g/I de NaHSO3, d = 1,32)
par 30 l, 60 1 ou vrac.
Dans ce dernier cas l'installation doit comprendre un dispositif de
neutralisation par la soude des vapeurs de SO2 qui se dégagent
lors du remplissage de la cuve de stockage.
Pour les petites installations, celles-ci seront logées dans
un local indépendant bien aéré.
Il faut:
---------------------------------------------------------
Nota : lien
(canadien) sur les effets de l'ozone sur la santé.
Par rapport aux procédés chimiques de désinfection, la technique utilisant le rayonnement ultraviolet, dont les propriétés bactéricides sont connues depuis de nombreuses années, présente l'avantage de ne pas induire de toxicité, et de ne pas générer de sous-produits sapides (cas du chlore).
Ce procédé est déjà largement utilisé en Suisse, et tend à se développer au Royume Uni, en Allemagne, en Suède, aux Pays-Bas et au Canada. L'une des plus grosses installations du monde se situe à Londres.
Mise en œuvre.
Les rayons ultraviolets sont produits par des lampes à
basse pression de mercure, qui présentent un rendement
germicide de l'ordre de 30 à 35 % (le rendement des lampes
à haute pression n'étant que de l'ordre de ô
%).
Néanmoins, tout générateur connaît une
baisse de rendement (de l'ordre de 15 à 25 % après 8000
heures de fonctionnement, soit en fin de vie) dont il faut tenir
compte lors des calcul de dimensionnement.
La désinfection s'effectue dans une chambre de traitement
où l'eau et irradiée par un ou plusieurs
générateurs U.V., chaque générateur
étant isolé du contact de l'eau par une gaine de quartz
perméable aux rayons U.V.
La désinfection est obtenue par circulation d'une mince lame
d'eau annulaire (d'épaisseur inférieure à 50 mm)
autour de ces gaines. Le régime hydraulique de
l'écoulement dans la chambre doit être turbulent et de
type piston, afin d'assurer une bonne
homogénéité du traitement (même temps
d'exposition pour tous les germes).
Dose létale d'exposition :
avec :
- P : puissance germicide de la source U.V. (en w),
- S : surface émettrice d'U.V. (en m²),
- T : temps d'exposition d'un élément de volume (en s),
- k : coefficient d'absorption des U.V. de l'eau à traiter (en m-1), ce coefficient varie de 2 à 10 m-1 (0,02 à 0,1 cm-1) pour les eaux de consommation,
- x : épaisseur de la lame d'eau (en m).
En France, la Direction Générale de la Santé
préconise, pour le traitement des eaux destinées
à la consommation humaine, une dose d'exposition minimale de
250 J/m² (ou 25 mJ/cm²) en tout point de la chambre
d'irradiation (circulaire du 19 Janvier 1987).
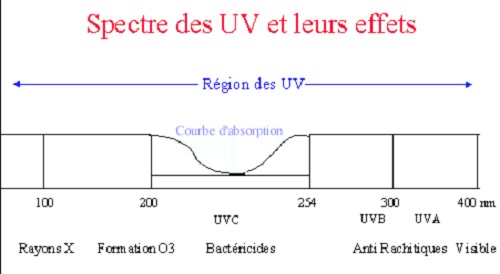
La résistance des micro-organismes au rayonnement U.V. peut
varier de manière importante, de quelques millijoules/cm2
à plusieurs joules/cm2.
Ainsi l'inactivation de certains micro-organismes sporulés et
levures, ainsi que de la plupart des moisissures, nécessite
une dose d'exposition très supérieure à 250
J/m2.
Pour assurer un effet bactériostatique dans le réseau
de distribution, il est nécessaire, dans la grande
majorité des cas, de prévoir une injection de chlore ou
de bioxyde de chlore pour compléter la désinfection aux
U.V.
Le type de générateur est choisi selon les conditions
locales, notamment: la qualité de l’eau, la transmittance
moyenne de l’eau et les les conditions hydrauliques, et pour le
traitement en piscines, la fréquentation du bassin, le taux de
chloramines et les options hydrauliques du bassin.
Liens : BIO-UV
(un des premiers fabricant français
d'appareils de traitement de l'eau par ultraviolets),
UVTECH
au Quebec/Canada.
Membranes.
Les membranes sont des barrières filtrantes
semi-perméables à fines pellicules. On les utilise, en
traitement de l'eau, pour éliminer différents
solutés et particules de tailles différentes.
Cinq procédés par membranes sont utilisés :
- Microfiltration (MF)
- Ultrafiltration (UF)
- Nanofiltration (NF)
- Osmose inverse (OI)
- Electrodialyse (ED)
Pour de plus amples renseignements, voir :
Le seuil limite de la taille des particules retenue par les différents types de membranes permet d'imaginer les techniques qui pourraient permettre une désinfection efficace :
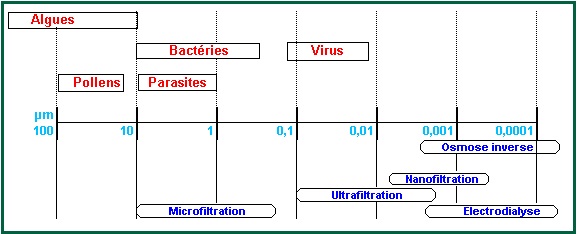
La Microfiltration seule n'est pas suffisante : une oxydation
chimique ou UV s'avère indispensable pour permettre
l'arrêt des virus.
Par ailleurs, l'Osmose inverse et l'Electrodialyse qui retiennent une
grande partie des sels dissous sont des techniques non
adaptées pour la seule désinfection.
On peut atteindre un niveau satisfaisant de traitement en associant
les procédés par membranes tels que l'Ultrafiltration
ou la Nanofiltration, avec des procédés conventionnels,
tels que la filtration classique (sable et/ou avec CAG) ou si la
qualité d'eau initiale s'y prête (turbidité
correcte) un passage direct sur ces membranes.
A noter donc que les deux procédés (UF à petits
pores et NF) qui effectuent une rétention importante des
micro-organismes, mais également d'une grande partie des
composés organiques, en particulier le COD
(Carbone Organique Dissous) et surtout le COD
Biodégradable (la "nourriture bactérienne"), donnent
une qualité d'eau parfaite du point de vue
hygiénique.
Types de configuration possibles :
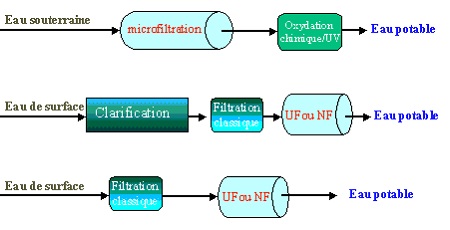
Lien pour en savoir plus sur les systèmes disponibles sur le marché français :
- VEOLIA Techniques membranaires,
- DEGREMONT (Grouoe Suez) Technologies,
- STEREAU (Groupe SAUR) > Procédés .
|
|