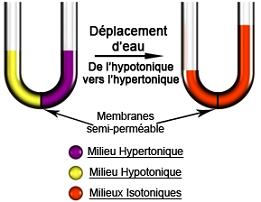
L' osmose est définie
(par sa mise en évidence
expérimentale) comme le phénomène de
diffusion de molécules de solvant (l'eau de
façon générale) à travers une
membrane semi-perméable qui sépare deux liquides de
concentrations en soluté différentes. La
différence de pression (pression
hydrostatique) est donc la force qui tend à
équilibrer les concentrations moléculaires qui
génèrent la pression osmotique.

Le passage de solvant d'un compartiment
à l'autre va créer une différence de pression
hydrostatique qui va compenser exactement la différence de
pression osmotique. Le phénomène d'osmose
nécessite la présence de deux compartiments
séparés par une membrane semi-perméable,
c’est-à-dire perméable uniquement à l'eau
(ou au solvant de façon plus
générale) et imperméable aux
solutés.
Lorsque les deux solutions ne contiennent pas le même nombre de
particules dissoutes par unité de volume, on observe un
mouvement d'eau qui va tenter de compenser cette différence de
concentration en diluant le compartiment le plus
concentré.
L’osmose est à l’origine de la turgescence
(état cellulaire associé à
l'élongation de la cellule végétale,
causée par une entrée d'eau dans cette même
cellule) et la plasmolyse (état
cellulaire résultant d'une perte d'eau par une cellule
végétale ou animale, notamment au niveau de sa
[ses]
vacuole[s] ) de la cellule végétale.
Cette notion est donc particulièrement utile en
physiologie et en biologie cellulaire pour expliquer
les échanges chimiques au sein des organismes vivants.
La pression osmotique se
définit donc comme la pression minimum qu’il faut exercer
pour empêcher le passage d’un solvant d’une solution
moins concentrée à une solution plus concentrée
au travers d’une membrane semiperméable
(membrane hémiperméable).
En biophysique, on distingue la pression oncotique qui est la part de
la pression osmotique due aux protéines. Il faut bien
comprendre que la pression osmotique se concrétise quand la
part de la fraction molaire du solvant aqueux n'est pas égal
à 1.
La pression osmotique est proportionnelle aux concentrations de
soluté de part et d’autre de la membrane et de la
température ; lorsque l’on est en présence de
plusieurs solutés, il faut prendre en compte la
totalité des solutés (à la
manière d’un gaz composé, somme des pressions
partielles).
La pression osmotique d'une solution idéale se calcule
par une formule développée par Van't Hoff en 1886, et
appliquant le deuxième principe de la thermodynamique :

NOTA :
La pression osmotique est aussi une pression mécanique,
exerçant une force sur la membrane. Si la différence de
pression osmotique est très grande, cela peut entraîner
la rupture de la membrane (cas de
l’hémolyse).
À l’inverse, si l’on exerce une pression
mécanique (hydrostatique), on peut
forcer le passage d’espèces à travers la membrane.
C’est ce qui arrive lors d’un œdème aigu du
poumon, et c’est ce que l’on utilise dans
l’osmose
inverse(*).
Ce phénomène est aussi observable sur les œufs des
poissons d'aquarium qui peuvent éclater ou s'écraser
selon la différence de pression osmotique de chaque
côté de la membrane, la coquille.
(*)
L'osmose inverse est une technique de
traitement de l'eau (voir par exemple : les
Traitemets
sur
membranes);
c'est aussi une technique de dessalement de l'eau de mer permettant
la production d'eau douce.
Utilisation industrielle.
Le principe osmotique peut être utilisé pour
produire de l'énergie électrique :
un prototype a été inauguré en Norvège
(à Tofte, municipalité de Hurum,
comté de Buskerud, à 58 km de la capitale
norvégienne), développée par la société
Statkraft (+ doc.pdf
sur le procédé à télécharger, 2.04
Mo, en anglais). L'usine dispose de deux réservoirs,
l'un contenant de l'eau de mer (à env.35 g/l
de salinité) et l'autre de l'eau douce, lesquels sont
séparés par une membrane semi-perméable. La
pression exercée est de 120 m CE (soit, 11,8
bar), pression hydraulique qui entraine une turbine et fournit
de l'électricité.